Te explicamos qué son los fenómenos químicos, sus características, clasificación y ejemplos. Además, qué son los fenómenos físicos.

¿Qué son los fenómenos químicos?
Los fenómenos químicos son procesos termodinámicos en los que dos o más sustancias, llamadas reactivos, cambian su estructura molecular y generan nuevas sustancias, llamadas productos. Los reactivos o productos pueden ser elementos o compuestos químicos. Los fenómenos químicos también se denominan reacciones químicas o cambios químicos, términos que son sinónimos.
En los fenómenos químicos se produce un cambio significativo en la materia, que nunca es la misma al inicio de la reacción que al final, de modo tal que suele ser irreversible y no siempre observable a simple vista. Por otro lado, las cantidades de materia y energía involucradas antes y después de que ocurre la reacción química, siempre se mantienen constantes.
Las reacciones químicas son comunes en nuestro día a día y muchas de ellas son clave en la fabricación de productos, la obtención de energía y otros procesos de importancia para la sociedad.
Ver también: Reacción exotérmica
Tipos de reacciones químicas

Antes de mostrar los distintos tipos de reacciones químicas, es importante conocer algunos de los símbolos que se emplean para representar dichas reacciones mediante ecuaciones químicas:
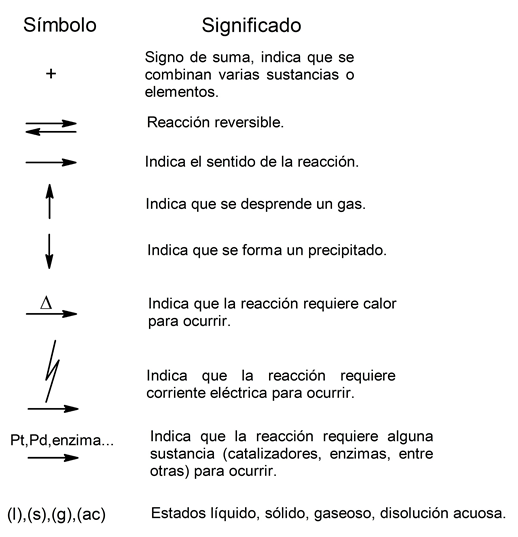
Las reacciones químicas se clasifican, ante todo, según los tipos de compuestos químicos que involucran. Tendremos, así, reacciones químicas orgánicas e inorgánicas, y cada tipo se clasifica de manera independiente:
Reacciones inorgánicas. Son las que involucran compuestos inorgánicos, y pueden ser clasificadas:
- Según el reordenamiento de los átomos de los reactivos cuando se transforman en productos:
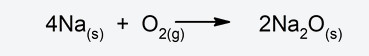
- Reacciones de síntesis o adición. Dos reactivos se combinan entre sí para dar como resultado una sustancia diferente.

- Reacciones de descomposición. Una sustancia reacciona con otra y se descompone en sus componentes más simples.

- Reacciones de sustitución o desplazamiento simple. Un compuesto o elemento ocupa el lugar de otro, dentro de un compuesto mayor o más complejo, sustituyéndolo y dejándolo libre.

- Reacciones de doble sustitución. Dos reactivos intercambian compuestos o elementos químicos simultáneamente.

- Reacciones de síntesis o adición. Dos reactivos se combinan entre sí para dar como resultado una sustancia diferente.
- Según la energía que se intercambia durante la reacción:
- Reacciones endotérmicas. Son reacciones que absorben calor cuando ocurren.

- Reacciones exotérmicas. Son reacciones que liberan calor cuando ocurren.

- Reacciones que necesitan luz para ocurrir. Son aquellas que absorben luz cuando ocurren.

- Reacciones que emiten luz cuando ocurren. Son aquellas que cuando ocurren emiten energía en forma de luz.

- Reacciones endotérmicas. Son reacciones que absorben calor cuando ocurren.
- Según la velocidad de reacción:
- Reacciones rápidas. Son reacciones que ocurren en muy poco tiempo.

- Reacciones lentas. Son reacciones en las que la formación de los productos a partir de ciertos reactivos tarda mucho.

- Reacciones rápidas. Son reacciones que ocurren en muy poco tiempo.
Reacciones orgánicas. Las reacciones orgánicas dependen del tipo de compuesto orgánico del que se trate, ya que cada grupo funcional posee un rango de reacciones específicas: los alcanos, alquenos, alcoholes, cetonas, aldehídos, etc.
Más en: Reacción química
Ejemplos de fenómenos químicos

Cualquier reacción química es un buen ejemplo de fenómenos químicos, incluso las que se dan en el interior de nuestros cuerpos. Podemos mencionar algunos casos sencillos:
- Oxidación. Podemos ver este fenómeno en los metales, especialmente en ambientes salinos (pues la sal actúa como catalizador, acelerando la reacción entre el oxígeno y el metal), y consiste en la formación de una capa de orín (u óxido) sobre la superficie del metal oxidado. Ocurre también en el interior de nuestros cuerpos, ya que con el oxígeno que tomamos al respirar, procedemos luego a oxidar las moléculas de glucosa, obteniendo energía química.
- Combustión. Es una reacción de oxidación rápida que puede provocar fuego. Por ejemplo, cuando encendemos con un fósforo un papel y lo observamos convertirse en cenizas. Este tipo de reacciones involucran un material combustible (el papel) y un comburente (el oxígeno del aire) en presencia de un aumento de temperatura.
- Corrosión. Es el resultado de una reacción electroquímica de un material (generalmente un metal) con el entorno que lo rodea. Cuando una sustancia se corroe, queda deteriorada y puede desgastarse, romperse o quebrarse. Materiales como la madera, la cerámica, algunos plásticos e incluso la piel humana, también pueden sufrir corrosión.
- La producción de sales. Cuando se mezclan un ácido y un metal, como en el caso del derrame del contenido de unas baterías viejas dentro del compartimiento del control remoto de un televisor, se produce una sal de algún tipo, dependiendo del metal y del ácido.
Fenómenos químicos y fenómenos físicos

La diferencia entre los fenómenos físicos y los fenómenos químicos tiene que ver con el tipo de cambio suscitado en la materia. Los fenómenos físicos están relacionados con los cambios de forma y de estado en los que la sustancia sigue siendo químicamente la misma, es decir, no implican reacciones químicas.
Por ejemplo, si congelamos agua, podemos convertirla en un sólido (hielo) sin que deje de estar conformada por hidrógeno y oxígeno.
En cambio, los fenómenos químicos reorganizan la estructura molecular de la materia, formando y rompiendo enlaces químicos entre los átomos y creando nuevas sustancias. Esto se debe a que ocurre una reacción química, generalmente irreversible, en la que se obtienen sustancias distintas a las iniciales.
Por ejemplo, luego de quemar un papel y convertirlo en cenizas, no podemos restaurarlo a su condición original.
Más en: Fenómenos físicos
Referencias
- “Reacción química” https://es.wikipedia.org/
- “Fenómenos químicos” en Portland Public Schools (español). http://www.pps.k12.or.us/
- “Chemical phenomena in life” https://www.nature.com/



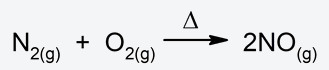

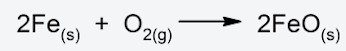

¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)