Te explicamos qué son los ácidos y las bases, sus características, indicadores y ejemplos. Además, qué es la reacción de neutralización.

¿Qué son los ácidos y bases?
Un ácido es aquella sustancia química capaz de ceder protones (H+) a otra sustancia química. Una base es aquella sustancia química capaz de captar protones (H+) de otra sustancia química.
Sin embargo, existen dos teorías fundamentales para explicar qué son los ácidos y las bases: la teoría de Arrhenius y la teoría de Brönsted-Lowry.
Según la teoría de Arrhenius:
Un ácido es aquella sustancia que cede protones (H+) en solución acuosa. Es decir, es una sustancia neutra, que cuando se disuelve en agua se disocia en sus iones según la siguiente reacción representativa:
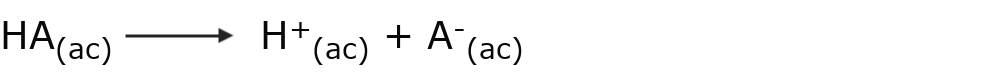
Por ejemplo: el ácido clorhídrico (HCl)
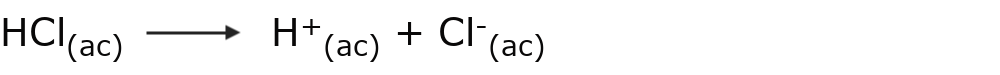
Una base es aquella sustancia que cede iones OH– en solución acuosa. Por ejemplo: el hidróxido de sodio (NaOH)
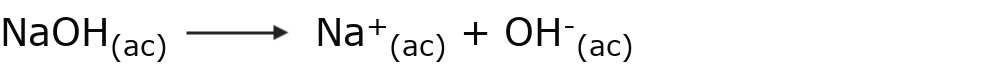
Esta teoría tiene sus limitaciones, pues según ella estos compuestos solo se definen en solución acuosa y no en otros medios. Además no explica compuestos como el amoníaco (NH3), que es una base, pero al no tener OH– en su composición, no cumple con la definición de base de Arrhenius.
Por todo esto, se necesitaba una nueva teoría que explicara mejor los conceptos de ácido y base. Así que más tarde Brönsted y Lowry desarrollaron una nueva teoría, que incluye los principios de Arrhenius pero no solo está pensada en solución acuosa, y por tanto, es mucho más amplia.
Según la teoría de Brönsted-Lowry:
Según esta teoría, un ácido es una sustancia química que es capaz de ceder protones (H+) a otra sustancia química y una base es aquella sustancia química que es capaz de captar protones (H+) de otra sustancia química.
Según esta teoría una reacción ácido-base es un equilibrio que se puede expresar como:
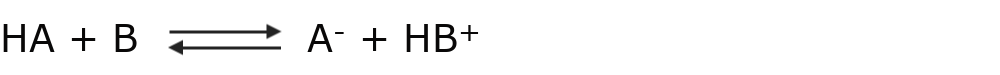
Donde HA se comporta como ácido, pues cede un protón H+ para quedarse como A–. Por otro lado, B se comporta como una base, pues capta un protón H+ para convertirse en HB+.
Algunas sustancias pueden comportarse como ácidos y como bases al mismo tiempo y se dice que son anfóteras. Esto depende del medio en que se encuentren o con quien reaccionen. Un ejemplo de este tipo de sustancias es el agua:
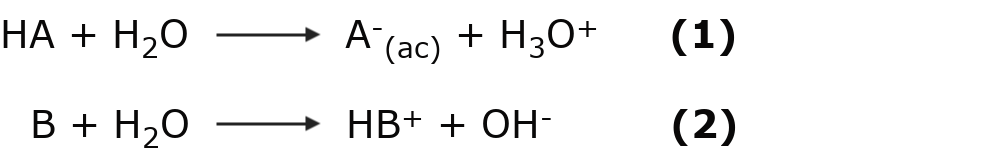
En la primera ecuación el agua capta un protón H+, comportándose como una base y convirtiéndose en H3O+. Mientras que en la ecuación (2), el agua cede un protón H+, comportándose como un ácido y convirtiéndose en OH–.
Por lo visto en ambas teorías, ácidos y bases tienen diferentes proporciones de iones hidrógeno (H+). Esto determina su acidez (en caso de ácidos) o su alcalinidad o basicidad (en caso de bases).
El pH es la magnitud que se utiliza para medir la acidez o la alcalinidad de una disolución, es decir, indica la concentración de iones hidrógeno presentes en esta.
- Ácidos. Sustancias con pH de 0 a 6.
- Neutros. Sustancia con pH 7 (el agua).
- Bases / alcalinos. Sustancias con pH de 8 a 14.
Cuanto menor sea el pH de una sustancia, mayor será su grado de acidez. Por ejemplo, el HCl puro tiene pH cercano a 0. Por otra parte, cuanto mayor sea el pH de una sustancia, mayor será su grado de alcalinidad. Por ejemplo, la soda caústica tiene pH igual a 14.
Puede servirte: Química inorgánica
Características de ácidos y bases
Tanto ácidos como bases pueden existir como líquidos, sólidos o gases. Por otro lado, pueden existir como sustancias puras o diluidas, conservando muchas de sus propiedades.
La diferencia de pH es el rasgo más notorio de cada uno. Cuando el valor de pH de un compuesto alcanza alguno de sus extremos, quiere decir que este compuesto es altamente peligroso para la mayoría de la materia, tanto orgánica, como inorgánica.
Los ácidos y las bases presentan características físicas diferentes:
Ácidos
- Presentan un sabor agrio (por ejemplo: ácido presente en diversos frutos cítricos).
- Son altamente corrosivos, pueden generar quemaduras químicas en la piel o daños respiratorios si se inhalan sus gases.
- Son buenos conductores de la electricidad en disoluciones acuosas.
- Reaccionan con metales produciendo sales e hidrógeno.
- Reaccionan con óxidos metálicos para formar sal y agua.
Bases
- Presentan un sabor amargo característico.
- Son buenos conductores de la electricidad en disoluciones acuosas.
- Son irritantes de la piel: disuelven la grasa cutánea y pueden destruir por su efecto cáustico la materia orgánica. Su respiración también es peligrosa.
- Poseen tacto jabonoso.
- Son solubles en agua.
Ácidos y bases en la vida cotidiana

La presencia de los ácidos y las bases en nuestra vida diaria es abundante. Por ejemplo, en el interior de las baterías de nuestros aparatos electrónicos suele haber ácido sulfúrico. Por eso, cuando se estropean y se vierte su contenido dentro del aparato, reaccionan con el metal de los electrodos y crean una sal blancuzca.
También hay ácidos suaves que manejamos a diario, como el ácido acético (vinagre), el ácido acetilsalicílico (aspirina), el ácido ascórbico (vitamina C), el ácido carbónico (presente en gaseosas carbonatadas), el ácido cítrico (presente en las frutas cítricas), o el ácido clorhídrico (el jugo gástrico que nuestro estómago segrega para disolver la comida).
En cuanto a las bases, el bicarbonato de sodio es empleado para hornear, como desodorante y en diversos remedios contra la acidez estomacal. Otras bases de uso común son el carbonato de sodio (detergente), hipoclorito de sodio (cloro para limpiar), hidróxido de magnesio (laxante) y el hidróxido de calcio (la cal de construcción).
Indicadores de ácidos y bases
La forma de distinguir entre un compuesto ácido y uno básico es midiendo su valor de pH. En la actualidad existen numerosos métodos para medir el pH de una sustancia.
- Usando indicadores ácido-base. Los indicadores son compuestos que cambian de color al cambiar el pH de la disolución en que se encuentren. Por ejemplo, la fenolftaleína es un líquido que toma color rosa si es añadido a una base y se torna incoloro si es añadido a un ácido. Otro ejemplo es el papel tornasol, que se sumerge en una disolución y si se torna rojo o anaranjado será una sustancia ácida y si se torna de un color oscuro será una solución básica.
- Usando un potenciómetro o pH-metro. Existen equipos electrónicos que nos dan directamente el valor de pH de una solución.
Reacción de neutralización
La reacción de neutralización o (reacción ácido-base) es una reacción química que ocurre cuando se mezclan estos dos tipos de compuestos, obteniendo a cambio una sal y cierta cantidad de agua. Estas reacciones suelen ser exotérmicas (generan calor) y su nombre proviene del hecho de que las propiedades de ácido y de base se anulan.
Para clasificar las reacciones de neutralización, es importante conocer los tipos de ácidos y bases.
- Ácido fuerte. Es un ácido que cuando está en solución acuosa se ioniza completamente, es decir, se transforma completamente en los iones que componen su molécula. Por ejemplo: HCl(ac), HBr(ac), H2SO4(ac).
- Base fuerte. Es una base que cuando está en solución acuosa se ioniza completamente, es decir, se transforma completamente en los iones que componen su molécula. Por ejemplo: NaOH(ac), LiOH(ac), KOH(ac).
- Ácido débil. Es un ácido que cuando está en solución acuosa se ioniza parcialmente, es decir, no se transforma completamente en los iones que componen su molécula. Por tanto, la concentración de iones en solución de este tipo de ácido es menor que en uno fuerte. Por ejemplo: el ácido cítrico, el ácido carbónico (H2CO3)
- Base débil. Es una base que cuando está en solución acuosa se ioniza parcialmente. Es decir, NO se transforma completamente en los iones que componen su molécula. Por tanto, la concentración de iones en solución de este tipo de base es menor que en una fuerte. Por ejemplo: amoníaco (NH3), hidróxido de amonio (NH4OH)
Las reacciones de neutralización pueden darse de cuatro formas, dependiendo de las propiedades de sus reactivos:
- Un ácido fuerte y una base fuerte. El reactivo más abundante quedará en disolución respecto del otro. El pH de la disolución resultante dependerá de cuál reactivo esté en mayor proporción.

- Un ácido débil y una base fuerte. Se obtendrá una disolución de pH básico, la base permanecerá en la disolución.

- Un ácido fuerte y una base débil. Se neutraliza el ácido y permanecerá una proporción ácida en disolución, dependiendo del grado de concentración del ácido. El pH de la disolución resultante es ácido.

- Un ácido débil y una base débil. El resultado será ácido o básico dependiendo de las concentraciones de sus reactivos.
Ejemplos de ácidos y bases
Ácidos
- Ácido clorhídrico (HCl)
- Ácido sulfúrico (H2SO4)
- Ácido nítrico (HNO3)
- Ácido perclórico (HClO4)
- Ácido fórmico (CH2O2)
- Ácido brómico (HBrO3)
- Ácido bórico (H3BO3)
- Ácido acético (C2H4O2)
Bases
- Soda cáustica (NaOH)
- Hidróxido de calcio (Ca(OH)2)
- Amoníaco (NH3)
- Bicarbonato de sodio (NaHCO3)
- Hidróxido de potasio (KOH)
- Hipoclorito de sodio (NaClO)
- Fluoruro de calcio (CaF2)
- Hidróxido de bario (Ba[OH]2)
- Hidróxido de hierro (III) (Fe[OH]3)
Sigue con: Fórmula química
Referencias
- “Ácidos y bases” https://es.khanacademy.org/
- “Ácidos y bases en la biología” https://www.ck12.org/
- “Neutralización de ácidos y bases” en Universidad del País Vasco. http://www.ehu.eus/
- “Acids and bases” https://www.encyclopedia.com/
- “Acids and Bases” en Lumen Learning. https://courses.lumenlearning.com/
- “Acids and Bases” https://www.bbc.co.uk/


¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)