Te explicamos qué es una reacción exotérmica y sus diferencias con una reacción endotérmica. Además, ejemplos de esta reacción química.

¿Qué es una reacción exotérmica?
Una reacción exotérmica es aquella que cuando ocurre libera energía en forma de calor o luz al ambiente. Cuando este tipo de reacción ocurre, los productos obtenidos tienen menor energía que los reactivos iniciales.
La entalpía es una magnitud que define el flujo de energía térmica en los procesos químicos que ocurren a presión constante. Además, esta magnitud representa el intercambio de energía entre un sistema termodinámico y su entorno. La variación de esta magnitud (ΔH) en una reacción química se utiliza para clasificarla en endotérmica o exotérmica.
ΔH>0 reacción endotérmica.
ΔH<0 reacción exotérmica.
Las reacciones exotérmicas son muy importantes en las ciencias bioquímicas. Mediante reacciones de este tipo, los organismos vivientes obtienen la energía necesaria para sostener la vida en un proceso llamado metabolismo.
La mayoría de las reacciones exotérmicas son de oxidación, y cuando son muy violentas pueden generar fuego, como en la combustión. Otros ejemplos de estas reacciones son las transiciones de la materia de un estado de agregación a otro de menor energía, como de gas a líquido (condensación), o de líquido a sólido (solidificación).
De hecho, muchas reacciones exotérmicas son peligrosas para la salud porque la energía liberada es abrupta y sin control, lo que puede producir quemaduras u otros daños a los seres vivientes.
Ver además: Principio de conservación de la energía
Diferencias entre reacciones exotérmicas y endotérmicas

En toda reacción química la energía se conserva. Esto constituye la ley de conservación de la energía: la energía no se crea ni se destruye, solo se transforma.
En las reacciones endotérmicas se absorbe energía para transformar los reactivos en productos. En este tipo de reacciones, los enlaces de las moléculas que constituyen los reactivos se rompen para formar nuevos componentes. Este proceso de ruptura de enlaces necesita la energía en cuestión. Un ejemplo de esto es el proceso de electrólisis del agua, donde se le suministra energía eléctrica a la molécula de agua para romperla y transformarla en los elementos que la constituyen.
Por otra parte, en las reacciones exotérmicas, los reactivos liberan energía química contenida en los enlaces que forman sus moléculas. La energía liberada puede ser en forma de calor o luz.
Más en: Reacciones endotérmicas
Ejemplos de reacción exotérmica
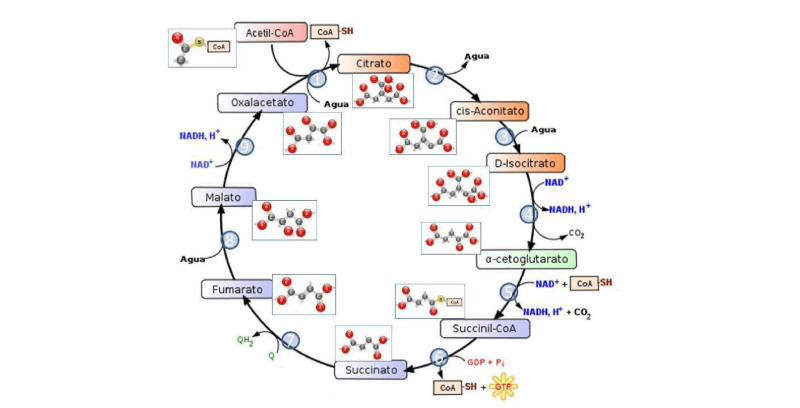
Algunas reacciones exotérmicas conocidas son:
- La combustión. Es una reacción de oxidación muy rápida que se produce entre materiales llamados combustibles y el oxígeno. Los combustibles están formados principalmente por carbono, hidrógeno y, en algunos casos, azufre. Ejemplos de combustibles son el gas metano, la gasolina y el gas natural. Esta reacción libera grandes cantidades de calor, lo que puede llevar a que se genere fuego.

- La oxidación de la glucosa. Esta es la reacción que llevamos a cabo los animales para obtener energía metabólica: tomamos el oxígeno de la respiración y lo usamos para oxidar los azúcares, rompiendo la molécula de glucosa en moléculas más simples (glucólisis) y obteniendo como recompensa moléculas de ATP, ricas en energía química.

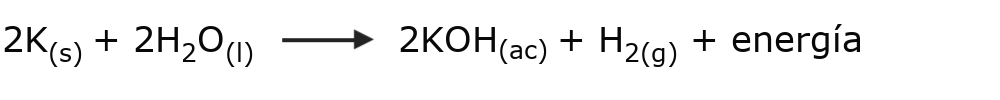
- La mezcla de potasio y agua. El potasio es un potente desecante que al ser mezclado con agua libera hidrógeno y enormes cantidades de energía en una explosión. Esto ocurre con todos los metales alcalinos, aunque no siempre con la misma cantidad de energía liberada.

- La formación de amoníaco. Para formar el amoníaco (NH3) se hace reaccionar nitrógeno (N2) e hidrógeno (H2), lo que supone la obtención de una molécula menos energética que las moléculas puestas en reacción. Esa diferencia de energía debe liberarse, y ocurre como un incremento de temperatura (calor).

Referencias
- “Reacción endotérmica y exotérmica” en el Portal Académico CCH de la Universidad Nacional Autónoma de México (UNAM) https://e1.portalacademico.cch.unam.mx/
- “Reacción exotérmica” en EcuRed https://www.ecured.cu/
- “Obtención de amoníaco” en https://quimica.laguia2000.com/.
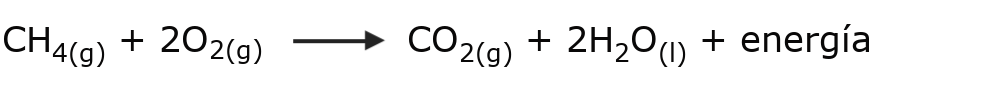
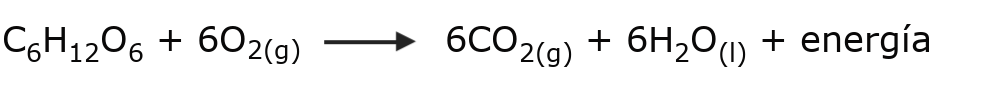
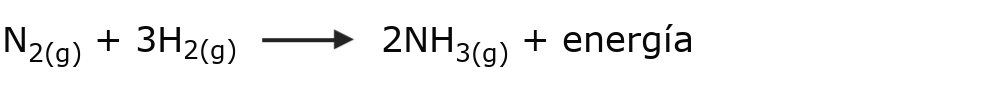
¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)