Te explicamos qué es el oxígeno, cuáles son sus propiedades, su función y usos. Además, su importancia y su historia.

¿Qué es el oxígeno?
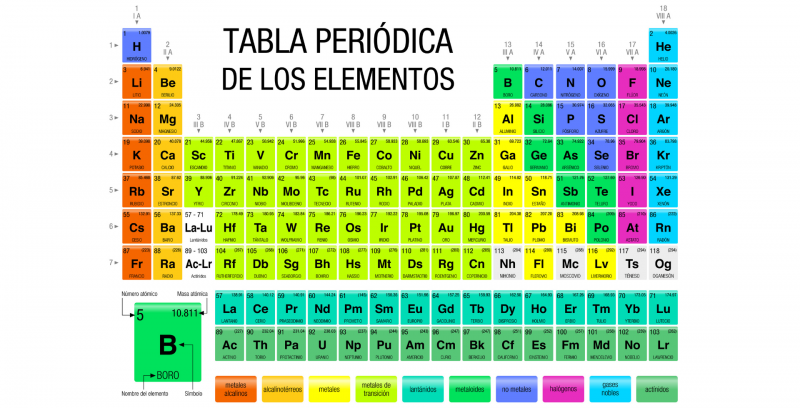
El oxígeno es un elemento químico de la Tabla Periódica que se representa con el símbolo O. Es el elemento más abundante en la Tierra y el más abundante del universo, después del helio (He) y el hidrógeno (H).
Tiene número atómico 8 y masa atómica 15.9994 uma. Es un no metal, es muy reactivo y tiene una electronegatividad (capacidad de un átomo de atraer hacia sí mismo los electrones del enlace químico que forma con otro átomo) muy alta, solo superada por la del flúor (F).
En condiciones normales de presión y temperatura (1 atm y 20 ⁰C) el oxígeno existe como oxígeno molecular (O2), un gas diatómico (formado por dos átomos) que es inodoro, incoloro e insípido. Además, el oxígeno compone aproximadamente el 21 % del aire.
Ver también: Litio
Propiedades del oxígeno
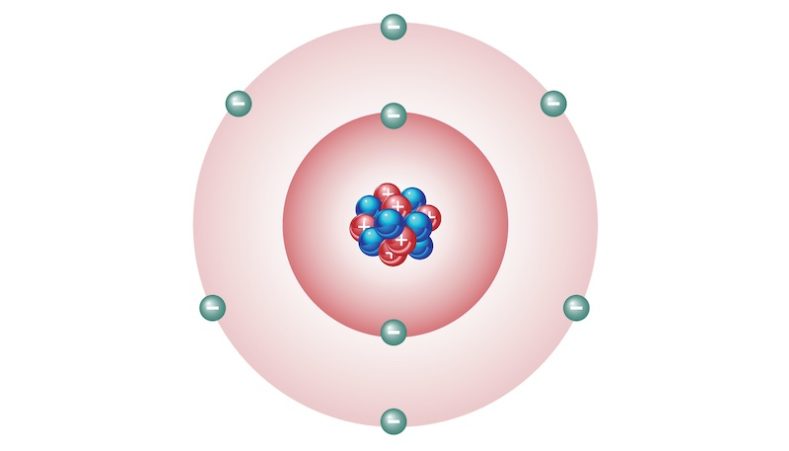
El oxígeno es un elemento químico muy reactivo que, si es sometido a distintas presiones y temperaturas, puede existir en distintos estados de agregación. Algunas de sus propiedades físicas y químicas son:
Propiedades físicas del oxígeno
- En condiciones normales de presión y temperatura es un gas inodoro, incoloro e insípido.
- Tiene un punto de ebullición de -183 ºC y un punto de fusión de -218.8 ºC.
- Cuando se condensa, se transforma en un líquido de color azul claro.
- Es soluble en agua.
- Es más pesado que el aire.
- Es paramagnético, es decir, se magnetiza ante un campo magnético. Esto significa que es atraído por un imán, aunque, si se retira el imán, el oxígeno se desmagnetiza.
Propiedades químicas del oxígeno
- Tiene estado de oxidación -2 en casi todos los compuestos químicos que forma, aunque cuando forma peróxidos (O22-) tiene estado de oxidación -1 y cuando forma superóxidos (O2–) tiene estado de oxidación -½.
- A elevadas temperaturas, forma óxidos con casi todos los elementos químicos.
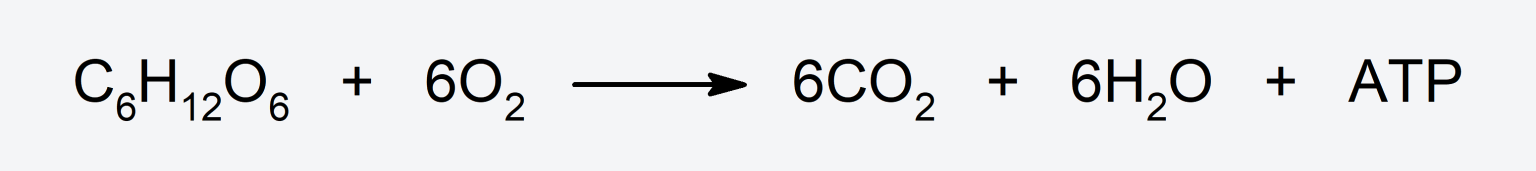
- Reacciona con compuestos orgánicos, como la glucosa, oxidándolos y produciendo dióxido de carbono (CO2), agua (H2O) y liberando energía en forma de ATP (adenosín trifosfato).

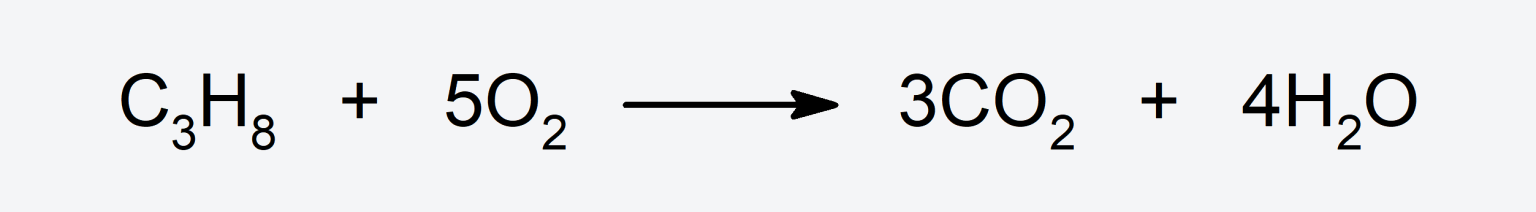
- Produce reacciones de combustión con compuestos orgánicos como el propano, en las que se produce dióxido de carbono (CO2), agua (H2O) y se libera energía en forma de luz y calor.

- Produce corrosión de metales como el hierro (Fe), y de esta forma forma óxidos.

Compuestos inorgánicos del oxígeno
Los compuestos inorgánicos son compuestos químicos que no tienen su estructura principal basada en el carbono, aunque pueden contener carbono. El oxígeno forma parte de muchos compuestos inorgánicos, y entre estos, algunos son compuestos químicos fundamentales para sostener la vida en el planeta. Este es el caso del agua (H2O) y el dióxido de carbono (CO2).
Algunos compuestos químicos inorgánicos que contienen oxígeno son:
El agua (H2O)
El agua es uno de los compuestos químicos más importantes para mantener la vida en el planeta. Constituye aproximadamente el 71 % de la corteza de la Tierra.
El dióxido de carbono (CO2)
El dióxido de carbono es uno de los compuestos químicos fundamentales para que las plantas realicen la fotosíntesis. Además, es un componente causante del efecto invernadero, por lo que es importante disminuir la emisión de este compuesto a la atmósfera.
Los óxidos metálicos
Los óxidos metálicos son compuestos formados por oxígeno y un metal. A altas temperaturas se forma una gran cantidad de óxidos, aunque a temperatura ambiente (25 ºC) también se forman óxidos. Por ejemplo:
- El óxido de hierro (III) (Fe2O3). Es el óxido que se encuentra en las estructuras fabricadas con acero o hierro.
- El óxido de hierro (II) (FeO). Es un compuesto explosivo, por lo que debe ser manipulado con precaución.
- El óxido de aluminio (Al2O3). Es uno de los componentes principales de las arcillas y los esmaltes. Se utiliza como aislante térmico y eléctrico.
- El óxido de magnesio (MgO). Es un óxido que se utiliza en la medicina, en la producción de cemento para la construcción y forma parte de los fertilizantes.
Los óxidos no metálicos
Los óxidos no metálicos son compuestos formados por oxígeno y un no metal. Por ejemplo:
- El monóxido de nitrógeno (NO) y el dióxido de nitrógeno (NO2). Son contaminantes de la atmósfera que contribuyen a formar el agujero de la capa de ozono.
- El dióxido de azufre (SO2) y el trióxido de azufre (SO3). A temperatura ambiente son gases. Son contaminantes y constituyen los principales componentes de la lluvia ácida.
- El óxido de cloro (VII) o heptóxido de dicloro (Cl2O7). Es un líquido aceitoso y volátil que explota cuando recibe impactos o entra en contacto con fuego.
Las oxisales
Las oxisales son sales que contienen oxígeno. Cuando se disuelven en agua, la disolución resultante conduce la electricidad. Por ejemplo:
- El sulfato de zinc (ZnSO4). Se utiliza en medicina como suplemento dietético.
- El carbonato de sodio (Na2CO3). Se utiliza en la producción de jabones y vidrio.
- El nitrato de potasio (KNO3). Se usa para producir fertilizantes y en la conservación de alimentos.
Compuestos orgánicos del oxígeno
Los compuestos orgánicos son compuestos químicos que tienen su estructura principal basada en el carbono, además, son los principales formadores del cuerpo de los organismos vivos. El oxígeno forma parte de muchos compuestos orgánicos, lo que hace que sea un elemento químico fundamental para sostener la vida en el planeta.
Algunos compuestos químicos orgánicos que contienen oxígeno son:
Los alcoholes
Los alcoholes son compuestos orgánicos que contienen un grupo funcional hidroxilo (-OH), formado por oxígeno (O) e hidrógeno (H). Por ejemplo:
- El metanol (CH3OH). Se emplea como anticongelante de vehículos y solvente de muchas sustancias.
- El etanol (CH3CH2OH). Se utiliza para producir bebidas alcohólicas, como disolvente y como desinfectante. Además, es empleado como combustible.
Los aminoácidos
Los aminoácidos son moléculas que constituyen las unidades que forman las proteínas. Por ejemplo:
- La cisteína. Es utilizada en la industria farmacéutica y alimenticia. Se encuentra principalmente en la carne cruda, en la leche materna y en algunos vegetales.
- La prolina. Es empleada en el tratamiento de enfermedades como la artritis, tendinitis y tortícolis. Se encuentra en el colágeno.
- La glicina. Se utiliza para desarrollar y recuperar los músculos después de un esfuerzo físico.

Los ácidos orgánicos
Los ácidos orgánicos son compuestos orgánicos que tienen el grupo funcional carboxilo (-COOH), formado por carbono (C), oxígeno (O) e hidrógeno (H). No se disuelven completamente en agua y son menos reactivos con los metales que los ácidos inorgánicos. Por ejemplo:
- El ácido metanoico o ácido fórmico (HCOOH). Es el ácido que inyectan algunas hormigas cuando pican. Es un componente de la miel.
- El ácido etanoico o ácido acético (CH3COOH). Es el ácido responsable del olor y el sabor del vinagre.
¿Para qué sirve el oxígeno?
El oxígeno es un elemento muy importante: la vida no sería posible sin el oxígeno, pero, además, los seres humanos hemos encontrado formas de darle uso a niveles industriales, para la fabricación de productos utilizados en muchos sectores, tanto metalúrgicos, cosméticos, como en la medicina.
Importancia biológica del oxígeno
El oxígeno es imprescindible para el mantenimiento de la vida de los seres vivos. El proceso de respiración celular, por el que los organismos vivos producen la energía necesaria para vivir, se realiza en presencia de oxígeno. Sin este elemento, los seres vivos no podrían respirar y se terminaría la vida en el planeta.
Gracias al constante ingreso de oxígeno a los organismos vivos es posible que puedan realizar sus funciones vitales como la respiración, la digestión, el crecimiento y la reproducción. Además, el oxígeno les permite a estos organismos tener la suficiente energía para moverse de un lugar a otro.
Usos industriales del oxígeno
El oxígeno se utiliza en diversos sectores industriales y es fundamental en muchos procesos, vehículos y equipos como:
- Equipos de asistencia respiratoria.
- Procesos de desinfección de aguas.
- Fabricación de vidrios.
- Fundición en hornos para la industria metalúrgica.
- Procesos que involucran oxidación controlada de compuestos químicos.
- Conservación y tratamiento de alimentos.
- Actividades y técnicas para criar especies acuáticas.
- Oxigenar interiores de aviones, naves espaciales y submarinos.
¿Dónde se encuentra el oxígeno?

El oxígeno se encuentra en forma gaseosa en la atmósfera como oxígeno molecular (O2), y forma aproximadamente el 21 % del aire. Además, el agua de los ríos, mares y lagos contienen oxígeno disuelto.
Por otra parte, el oxígeno se encuentra formando parte de algunas moléculas fundamentales para sostener la vida en el planeta, como el agua (H2O), el dióxido de carbono (CO2), los aminoácidos que forman las proteínas y el ADN. El oxígeno es parte de los organismos vivos.
El oxígeno también forma el ozono (O3) en la capa de ozono, y a alturas que superan la órbita baja de la Tierra, se encuentra en forma de oxígeno atómico (O).
Impacto ambiental de las alteraciones en los niveles de oxígeno
La disminución del oxígeno en el planeta puede provocar severos daños a los organismos vivos, o incluso, la muerte. Una problemática en la actualidad es el uso de fertilizantes, que se escurren a los lagos y ríos, y provocan un exceso de nutrientes que genera la superpoblación de microorganismos y algas que consumen mucho oxígeno disuelto.
Este proceso se llama eutrofización y provoca la disminución del oxígeno disuelto, lo que a su vez causa la muerte de peces y otros animales acuáticos que no tienen oxígeno suficiente para vivir. Por otro lado, el aumento de la temperatura de las aguas ha provocado también una disminución de oxígeno disuelto que conlleva la muerte de la vida acuática.
Descubrimiento e historia del oxígeno
En 1772 el farmacéutico Carl Wilhelm Scheele logró producir oxígeno gaseoso a partir del calentamiento de óxido de mercurio (II) (HgO) y algunos nitratos. A este oxígeno producido le llamó “aire de fuego”. No obstante, este descubrimiento fue publicado en el año 1777.
Por otro lado, en 1774 Joseph Priestley hizo que la luz solar impactara sobre óxido de mercurio (II) (HgO) que estaba contenido en un tubo de cristal, y pudo ver que dentro del tubo comenzó a aparecer un gas. También notó que si colocaba un ratón y velas en contacto con ese gas, el ratón se ponía más activo y las velas se prendían más fuertemente. Luego, en 1775, publicó el resultado de sus experimentos en el artículo “Informe de más descubrimientos en el aire”. Es Joseph Priestley a quien se considera el descubridor del oxígeno, pues publicó primero sus descubrimientos.
Por otra parte, el francés Antoine Lavoisier (químico, biólogo y economista) utilizó los estudios que comenzaron en 1774 para explicar el proceso de combustión y además realizó los primeros ensayos de laboratorio sobre la oxidación.
Luego, en 1777, Lavoisier publicó un libro llamado “Sur la combustion en général”, en el que muestra que el aire es una mezcla de dos gases y los denominó 1) “aire esencial” (porque la parte del aire que sirve para la combustión y la respiración) y 2) el “azote”, que es la parte restante del aire. A este “aire esencial” más tarde lo nombró como oxígeno.
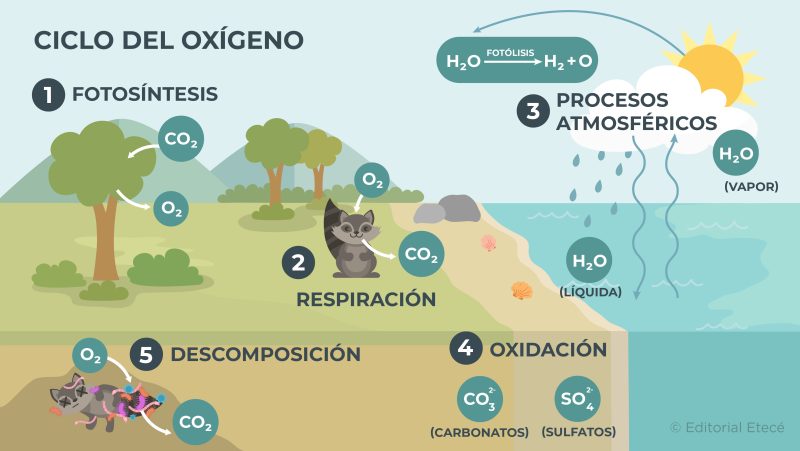
Ciclo del oxígeno
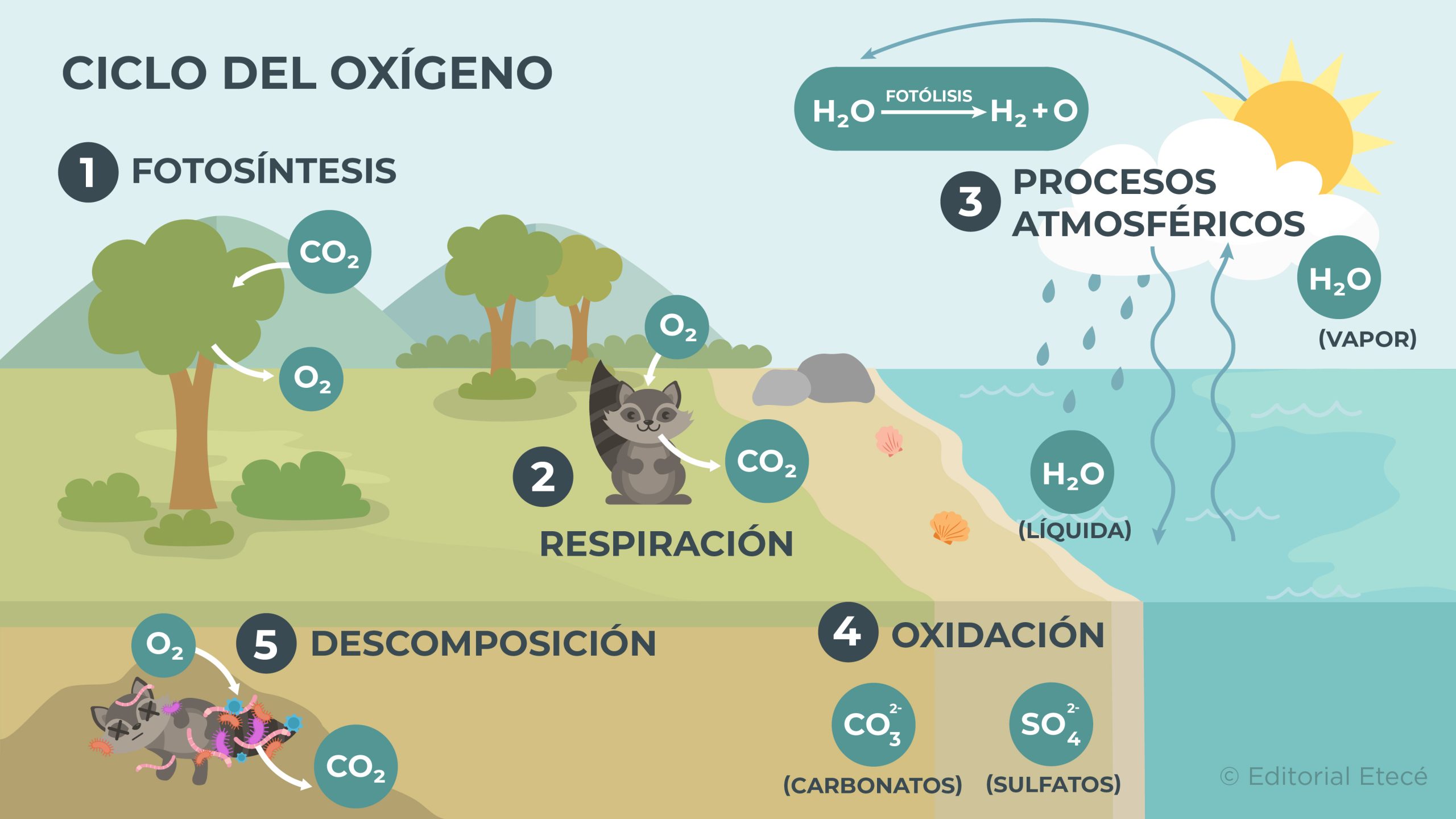
El ciclo del oxígeno es la circulación del oxígeno entre los distintos ecosistemas del planeta y el entorno que los rodea. Además, este ciclo tiene varias etapas:
Etapa rápida o biológica
Esta etapa involucra los procesos biológicos que ocurren en los seres vivos. Por ejemplo:
- Fotosíntesis. Es el proceso mediante el cual las plantas, las algas y el fitoplancton utilizan agua, dióxido de carbono (CO2) y luz solar para producir los nutrientes necesarios que les permiten obtener energía para vivir. Por otro lado, cuando estos organismos realizan la fotosíntesis, expulsan oxígeno (O2) a la atmósfera.
- Respiración. Es el proceso mediante el cual muchos organismos vivos utilizan el oxígeno para convertir ciertos nutrientes en energía. Cuando estos organismos realizan la respiración expulsan dióxido de carbono (CO2) y vapor de agua (H2O(g)) a la atmósfera.
Etapa lenta o geológica
Esta etapa involucra los procesos de oxidación de algunos elementos químicos y la descomposición de ciertos compuestos químicos. Por ejemplo:
- Parte del ciclo hidrológico y procesos atmosféricos. Durante el ciclo hidrológico ocurre la evaporación del agua de la superficie terrestre. Luego, las moléculas de agua presentes en la atmósfera interactúan con la radiación solar, que las separa en oxígeno e hidrógeno.
- Oxidación. Cuando ocurre la oxidación de elementos químicos, se forman compuestos químicos que contienen oxígeno y que luego pueden descomponerse y liberar el oxígeno.
- Descomposición. Cuando mueren organismos, estos se descomponen por la acción de ciertos microorganismos que utilizan oxígeno para realizar el proceso de descomposición y luego liberan CO2.
Sigue con:
Referencias
- Torres, W. H. (2002). Biología de las especies de oxígeno reactivas. Mensaje bioquímico, 26, 19-54.
- Mora Orozco, C. D. L., Flores López, H. E., Durán Chávez, Á., & Ruiz Corral, J. A. (2011). Cambio climático y el impacto en la concentración de oxígeno disuelto en el Lago de Chapala. Revista mexicana de ciencias agrícolas, 2(SPE2), 381-394.
- Djerassi, C., & Hoffman, R. (2014). Oxígeno: obra en 2 actos. Fondo de Cultura Económica.
- Chacón Sánchez, L. A. (2019). El oxígeno.

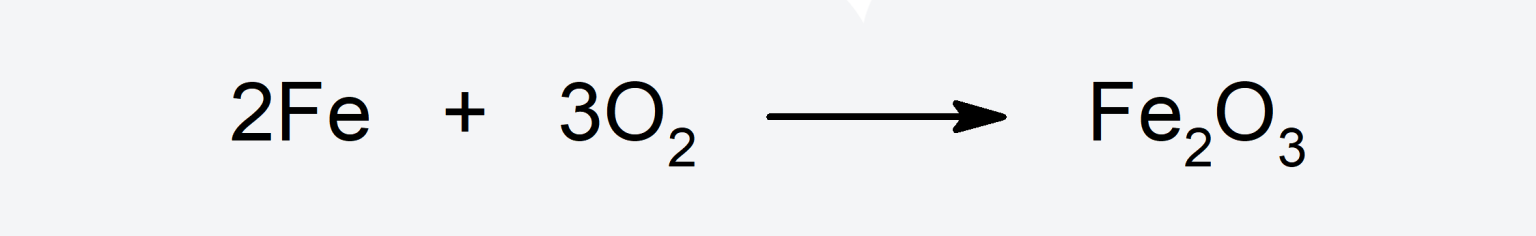

¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)