Te explicamos qué es un átomo, sus propiedades y cada una de las partes que componen su estructura. Además, su historia y evolución.

¿Qué es un átomo?
Se conoce como átomo a la unidad más pequeña que constituye los elementos químicos.
Los átomos tienen las propiedades del elemento químico que componen y, a su vez, los elementos están organizados y clasificados según sus números atómicos, configuración electrónica y propiedades químicas en la Tabla Periódica de los elementos.
Los átomos que pertenecen a un mismo elemento químico tienen igual cantidad de protones, es decir, tienen el mismo número atómico. Por otro lado, existen distintos átomos de un mismo elemento que difieren en su número de neutrones, y son llamados isótopos. Así, un caso representativo son los isótopos del elemento carbono (12C, 13C, 14C).
La palabra átomo proviene del griego antiguo (átomon, “sin división”) y fue acuñada por los primeros filósofos en teorizar sobre la composición de las cosas, es decir, las partículas elementales del universo. Desde entonces, con el surgimiento de los modelos atómicos, la forma de describirlos ha variado enormemente, a medida que un modelo atómico sucedía al anterior a través de los siglos y hasta la actualidad.
Ver además: Modelos atómicos
Propiedades del átomo
Las propiedades de los átomos se pueden utilizar para identificarlos y determinar a qué elemento químico pertenecen. Algunas de las propiedades que caracterizan a los átomos son:
- Tamaño. El tamaño de los átomos está determinado aproximadamente por el tamaño de su nube de electrones. El radio atómico es una medida de las dimensiones de un átomo, y se puede medir utilizando la distancia entre dos núcleos atómicos en una molécula.
- Masa. La masa del átomo está representada mayormente por la suma de las masas de sus nucleones. También, la suma de las masas de sus electrones hacen un aporte, pero en menor medida.
- Número atómico. Es la cantidad de protones que tiene un átomo. Los átomos que pertenecen a un mismo elemento químico tienen el mismo número atómico.
- Número másico. Es la suma de la cantidad de protones más la cantidad de neutrones.
Partes del átomo

Los átomos están compuestos por un núcleo y uno o varios electrones (que tienen carga negativa) y que están localizados alrededor del núcleo. Así, las partes que componen la estructura del átomo son:
Núcleo atómico
Alrededor del 99,94 % de la masa de un átomo está representada por el núcleo. El núcleo está compuesto por dos partículas:
- Protones, que tienen carga positiva.
- Neutrones, que son neutros.
Al conjunto de protones y neutrones se les llama nucleones. Los nucleones se atraen entre sí por la fuerza nuclear fuerte (fuerza que experimentan únicamente las partículas que componen el núcleo atómico). Esta fuerza atractiva es mucho más fuerte que la fuerza repulsiva que experimentan los protones, debido a que son partículas que tienen la misma carga eléctrica.
Nube electrónica o nube de electrones
Es la región ubicada alrededor del átomo en la que están organizados y distribuidos los electrones. En esta región los electrones están en movimiento y su localización está descrita por los orbitales atómicos.
Un orbital atómico describe una región del espacio que rodea al núcleo atómico en la que la probabilidad de encontrar un electrón es muy alta. Estas regiones tienen diferentes formas que son obtenidas como resultado de resolver la ecuación estacionaria de Schrödinger. Así, los electrones forman una especie de “nube” alrededor del núcleo, que está representada por la forma de los orbitales atómicos. Por otra parte, cada orbital atómico corresponde a un cierto valor de energía para los electrones, por lo que están organizados según sus valores de energía.
Los electrones y protones se atraen entre sí por la fuerza electromagnética, que es la interacción que presentan las partículas cargadas con campos eléctricos y magnéticos.
Más en: Estructura del átomo
¿Cómo se combinan los átomos?
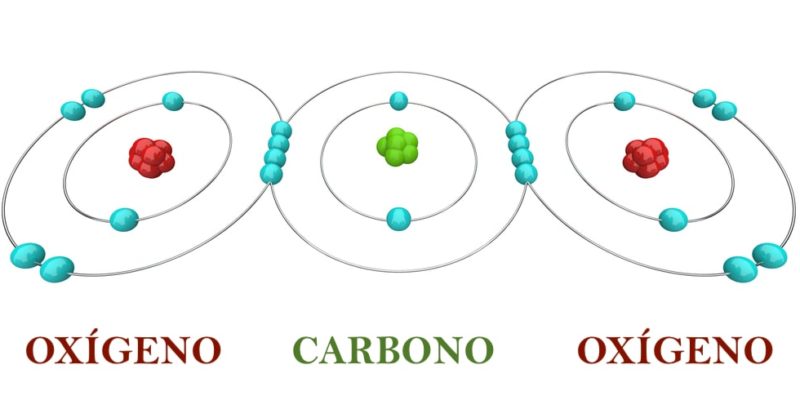
Los átomos pueden combinarse entre sí para formar enlaces químicos, lo que ocurre cuando comparten de una u otra forma sus electrones. Los enlaces químicos pueden ser covalentes, iónicos y metálicos, lo que origina compuestos moleculares covalentes, redes iónicas o compuestos metálicos (aunque es importante aclarar que ningún enlace químico es absolutamente covalente o iónico).
De esta forma, los átomos se combinan para formar moléculas sencillas como el agua, así como también para formar macromoléculas complejas como proteínas, ADN y ARN.
Por otra parte, los átomos que pertenecen a un mismo elemento químico se pueden combinar de distintas maneras para formar distintos compuestos químicos.
Por ejemplo, dos átomos de hidrógeno (H) y un átomo de oxígeno (O) se combinan para formar la molécula de agua (H2O), mientras que dos átomos de hidrógeno y dos átomos de oxígeno se combinan para formar la molécula de peróxido de hidrógeno (H2O2).
Ver también: Compuesto químico
Historia del átomo
La primera definición de átomo surgió antiguamente debido a la necesidad imperante de explicar cómo estaba compuesta la materia. Así, en la antigua Grecia, los filósofos Leucipo, Epicuro y Demócrito propusieron las primeras ideas sobre la existencia de los átomos, y para esto utilizaron un basamento filosófico y no la experimentación.
Estos filósofos propusieron que los átomos eran indivisibles e indestructibles y, además, eran las unidades que componían la materia. Igualmente, estos estudios fueron opacados por la explicación creacionista del mundo, que atribuía todo a Dios.
Un paso importante en el desarrollo de la teoría atómica ocurrió en 1773, cuando el químico francés Antoine-Laurent de Lavoisier propuso la ley de conservación de la masa, que plantea que la materia no se crea ni se destruye, solo se transforma. Esta ley fue demostrada en 1804 por el químico inglés John Dalton, quien además planteó que los átomos de cada elemento químico son esféricos e idénticos.
Sucesivos estudiosos de la física y la química se inspiraron en su trabajo para proponer mejores y más complejos sistemas de comprensión de las partículas fundamentales de la materia. Posteriormente, se propusieron nuevos modelos atómicos hasta llegar a los más utilizados actualmente.
Puede servirte: Modelo atómico de Demócrito
Evolución del modelo atómico
A través de los años se han ido proponiendo sucesivos modelos atómicos para representar, describir y explicar la estructura y propiedades del átomo.
Modelo atómico de Dalton
El modelo atómico de Dalton fue propuesto en 1803 por el químico y matemático británico John Dalton. Fue el primer modelo atómico con bases científicas.
Está basado en los siguientes postulados:
- Los átomos son indivisibles e indestructibles.
- Los átomos de un mismo elemento químico son idénticos.
- Los átomos se dividen, incluso aunque participen en reacciones químicas.
- La materia está formada por átomos.
- Los compuestos químicos se forman al combinarse átomos de dos o más elementos químicos distintos.
Más en: Modelo atómico de Dalton
Modelo atómico de Thomson
El modelo atómico de Thomson fue propuesto en 1897 por el científico británico Joseph John Thomson, quien además descubrió el electrón. Plantea que el átomo está formado por una esfera de carga positiva y los electrones están incrustados en ella, similar a las pasas en un pudín.
Se le conoce como el modelo del “budín con pasas”. Planteó que:
- Los átomos tienen una estructura interna compuesta por electrones distribuidos en una esfera positiva.
- En el átomo, la carga positiva es igual a la carga negativa, por eso los átomos son eléctricamente neutros.
Más en: Modelo atómico de Thomson
Modelo atómico de Rutherford
El modelo atómico de Rutherford fue propuesto en 1911 por el físico neozelandés Ernest Rutherford. Establece la existencia del núcleo atómico. Propone que:
- El átomo está formado por un núcleo positivo y los electrones giran alrededor de él.
- La mayor parte de la masa del átomo está representada por el núcleo.
Más en: Modelo atómico de Rutherford
Modelo atómico de Bohr
El modelo atómico de Bohr fue propuesto en 1913 por el físico danés Niels Bohr. Establece la cuantización de las órbitas que describen los electrones. Postula que:
- Las órbitas que describen los electrones tienen una energía definida, mientras más externa es la órbita, más energía tiene.
- Los electrones no irradian energía mientras estén en una órbita estable.
- Los electrones solo pueden estar en órbitas permitidas.
- Si un electrón salta de una órbita permitida de mayor energía, a otra órbita permitida de menor energía, emite energía en forma de radiación electromagnética.
Más en: Modelo atómico de Bohr
Modelo atómico de Sommerfeld
El modelo atómico de Sommerfeld fue propuesto en 1916 por el físico alemán Arnold Sommerfeld. Este modelo es una visión relativista del modelo atómico de Bohr, pues Sommerfeld descubrió que algunos electrones alcanzan velocidades cercanas a la velocidad de la luz. Postula que:
- Los electrones giran alrededor del núcleo atómico describiendo órbitas circulares y elípticas.
- Los electrones tienen pequeñas corrientes eléctricas.
- A partir del segundo nivel de energía, existen subniveles de energía.
Más en: Modelo atómico de Sommerfeld
Modelo atómico de Schrödinger
El modelo atómico Schrödinger fue propuesto en 1926 por el filósofo y físico austríaco Erwin Schrödinger. En este modelo los electrones se dejan de considerar como pequeñas esferas, y se consideran como ondas de materia. Plantea que:
- Los electrones se comportan como nubes electrónicas alrededor del núcleo.
- Los electrones tienen comportamiento ondulatorio.
- El estado de los electrones puede ser descrito por una función de onda, que es una función que elevada al cuadrado da la probabilidad de encontrar a un electrón alrededor del núcleo atómico.
Más en: Modelo atómico de Schrödinger
Molécula

Se conoce como molécula a la unión de dos o más átomos mediante enlaces químicos para formar una estructura más compleja, estable y eléctricamente neutra. Los enlaces químicos pueden ser covalentes o iónicos.
Las moléculas pueden estar constituidas por átomos de un mismo elemento químico, por ejemplo, la molécula de oxígeno (O2), o por átomos de distintos elementos químicos, por ejemplo, la molécula de glucosa (C6H12O6).
Sigue con:
Referencias
- Sundaresan, M.K. (2001) Handbook of particle physics. CRC Press, Washington, D.C.
- Cottingham, W.N.; Greenwood, D.A. (2004). An introduction to nuclear physics. Cambridge University Press. ISBN 0-521-65149-2.
- Halliday, David. Fundamentals of Physics (2007) 8ª edición, Wiley. ISBN 0-471-15950-6.





¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)