Te explicamos qué es un enlace iónico y sus propiedades. Ejemplos y aplicaciones de compuestos formados con este tipo de enlaces.
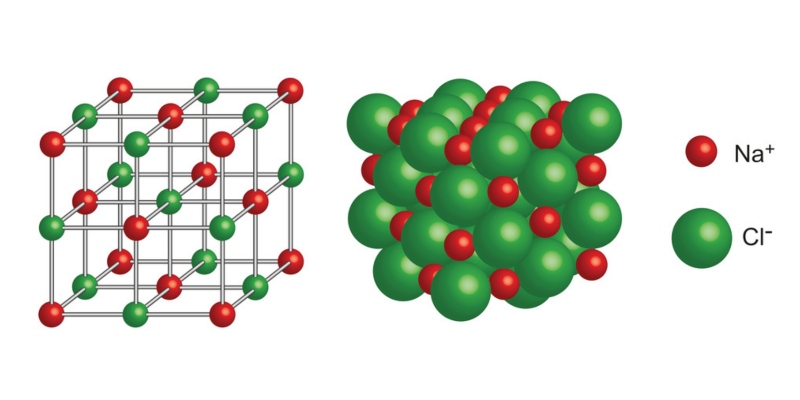
¿Qué es un enlace iónico?
El enlace iónico o electrovalente consiste en la atracción electrostática entre partículas con cargas eléctricas de signos contrarios llamados iones.
Un ion es una partícula cargada eléctricamente. Puede ser un átomo o molécula que perdió o ganó electrones, es decir, que no es neutro.
Este tipo de enlace se manifiesta generalmente entre átomos metálicos y no metálicos en los que la transferencia de electrones ocurre desde los átomos metálicos (menos electronegativos) hacia los no metálicos (más electronegativos).
Para que se forme un enlace iónico es necesario que la diferencia de electronegatividad (capacidad de un átomo de atraer electrones de otro átomo cuando se combinan en un enlace químico) entre ambos tipos de átomos sea mayor o igual que 1,7 en la escala de Pauling, utilizada para clasificar los átomos según sus valores de electronegatividad.
Si bien el enlace iónico se suele distinguir del covalente (consistente en compartir pares electrónicos de la capa externa o de valencia de ambos átomos), en realidad no existe un enlace iónico puro sino que este modelo consiste en una exageración del enlace covalente, útil para el estudio del comportamiento atómico en estos casos. Siempre existe algún margen de covalencia en estas uniones.
Sin embargo, a diferencia de los átomos que forman los enlaces covalentes que constituyen a menudo a las moléculas polares, los iones no poseen un polo positivo y otro negativo, sino que en ellos predomina por entero una sola carga. Así, tendremos cationes cuando un átomo pierde electrones (queda con carga positiva) y aniones cuando un átomo gana electrones (queda con carga negativa).
Puede servirte: Enlace metálico
Propiedades de los compuestos iónicos
Algunas características generales de un compuesto iónico:
- Son enlaces fuertes. La fuerza de esta unión atómica puede ser muy intensa, por lo que la estructura de estos compuestos tiende a formar redes cristalinas muy resistentes.
- Suelen ser sólidos. A temperaturas y rangos de presión normales (T=25ºC y P=1atm), estos compuestos tienen estructura molecular cúbica y rígida, que forma redes cristalinas que originan sales. También existen líquidos iónicos denominados “sales derretidas”, que son poco frecuentes, pero sumamente útiles.
- Poseen un alto punto de fusión y ebullición. Tanto el punto de fusión(entre 300 ºC y 1000 ºC) como el de ebullición de estos compuestos suele ser muy alto, pues se requieren grandes cantidades de energía para romper la atracción electrostática entre los iones.
- Solubilidad en agua. La mayoría de las sales son solubles en agua y otras soluciones acuosas que presenten un dipolo eléctrico (polos positivo y negativo).
- Conducción eléctrica. En su estado sólido no son buenos conductores de electricidad, dado que los iones ocupan posiciones muy fijas en una red cristalina. En cambio, una vez disueltos en agua o en solución acuosa, se tornan eficaces conductores de la electricidad.
- Selectividad. Los enlaces iónicos pueden darse únicamente entre metales de los grupos IA y IIA de la Tabla Periódica, y los no metales de los grupos VIA y VIIA.
Ejemplos de enlace iónico
- Fluoruros (F–). Aniones que forman parte de sales obtenidas a partir del ácido fluorhídrico (HF). Son empleadas en la fabricación de pastas dentales y otros insumos odontológicos.
Ejemplos: NaF, KF, LiF, CaF2 - Sulfatos (SO42-). Aniones que forman parte de sales o ésteres obtenidas a partir del ácido sulfúrico (H2SO4), cuya unión a un metal tiene aplicaciones diversas, desde aditivos en la obtención de materiales de construcción, hasta insumos para radiografías de contraste.
Ejemplos: CuSO4, CaSO4, K2SO4 - Nitratos (NO3–). Aniones que forman parte de sales o ésteres obtenidos del ácido nítrico (HNO3), empleados en la manufacturación de la pólvora y en numerosas formulaciones químicas para abonos o fertilizantes.
Ejemplos: AgNO3, KNO3, Mg(NO3)2 - Mercurio II (Hg2+). Un catión obtenido a partir del mercurio, llamado también catión mercúricoy que es solo estable en medios de pH ácido (<2). Los compuestos de mercurio son tóxicos para el organismo humano, por lo que deben ser manipulados con determinadas precauciones.
Ejemplos: HgCl2, HgCN2 - Permanganatos (MnO4–). Las sales del ácido permangánico (HMnO4) poseen un intenso color púrpura y un enorme poder oxidante. Estas propiedades pueden ser aprovechadas en la síntesis de la sacarina, en el tratamiento de aguas residuales y en la fabricación de desinfectantes.
Ejemplos: KMnO4, Ca(MnO4)2
Sigue con:








¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)