Te explicamos qué son las fuerzas de Van der Waals y en qué casos se manifiestan. Además, por qué llevan tal nombre y sus características.

¿Qué son las fuerzas de Van der Waals?
Se conoce como fuerzas de Van der Waals o interacciones de Van der Waals a un cierto tipo de fuerzas intermoleculares atractivas o repulsivas, diferentes de aquellas que generan los enlaces atómicos (iónicos, metálicos o covalentes de tipo reticular) o la atracción electrostática entre iones y otras moléculas.
Antes de mencionar los distintos tipos de fuerzas de Van der Waals, es importante entender qué es la polaridad química. La polaridad química es una propiedad de las moléculas que tienden a separar las cargas eléctricas en su estructura. Es una propiedad muy relacionada con las fuerzas intermoleculares (como las de Van der Waals), con la solubilidad y con los puntos de fusión y ebullición. Dependiendo de la polaridad, las moléculas pueden ser clasificadas en:
- Moléculas polares. Están formadas por átomos con electronegatividad muy diferente. El átomo con mayor electronegatividad atrae los electrones del enlace y queda con una densidad de carga negativa sobre él. Por otra parte, el átomo con menor electronegatividad quedará con una densidad de carga positiva sobre él. Esta distribución de cargas llevará finalmente a la formación de un dipolo (sistema de dos cargas de signo opuesto e igual magnitud).

- Moléculas apolares. Están formadas por átomos con igual electronegatividad, por lo que todos los átomos atraen de igual manera los electrones del enlace.Un factor que también determina la polaridad de una molécula es la simetría molecular. Existen moléculas compuestas por átomos de diferente electronegatividad, pero que no son polares. Esto ocurre porque cuando se suman las distintas densidades de carga de las partes de la molécula, se anulan y resultan en un momento dipolar nulo.

Entonces, las fuerzas de Van der Waals se manifiestan de tres formas particulares:
- Fuerzas de atracción de Keesom (interacciones dipolo-dipolo). Son interacciones entre moléculas polares, es decir, permanentemente polarizadas. Así, estas moléculas tienen un polo positivo (con densidad de carga positiva 𝛅+) y uno negativo (con densidad de carga negativa 𝛅–), y se orientan de forma que el polo positivo se acerque con el polo negativo.

- Fuerzas de atracción de Debye (interacciones dipolo permanente-dipolo inducido). Tienen lugar entre una molécula polar y otra apolar, pero que presenta una polaridad inducida. En este tipo de interacción, el dipolo induce un dipolo transitorio en la molécula apolar.

- Fuerzas de dispersión de London (dipolo inducido-dipolo inducido). Son interacciones que ocurren entre moléculas apolares. El movimiento de electrones en estas moléculas induce dipolos transitorios, lo que provoca cierta atracción entre ellas. Son interacciones muy débiles.

A la totalidad de estas fuerzas intermoleculares se las conoce como Fuerzas de Van der Waals, nombre que hace homenaje al físico holandés Johannes Diderik van der Waals (1837-1923), el primero en proponer sus efectos en las ecuaciones de estado de un gas (conocida como Ecuación de Van der Waals) en 1873. Por este hallazgo se le concedió el Premio Nobel de Física en 1910.
Ver también: Energía potencial
Características de las Fuerzas de Van der Waals

Las fuerzas de Van der Waals resultan, por lo general, débiles en comparación con los enlaces químicos ordinarios, lo que no les impide resultar fundamentales para diversos campos de la física, la biología y la ingeniería. Gracias a ellas muchos compuestos químicos pueden ser definidos.
Las fuerzas de Van der Waals crecen con la longitud del extremo no polar de una sustancia, puesto que están causadas por correlaciones entre las polarizaciones fluctuantes entre átomos, moléculas o superficies cercanas, consecuencia de la dinámica cuántica.
Presentan anisotropía, es decir, sus propiedades varían dependiendo de la orientación de las moléculas: de ello a menudo depende que sean de atracción o de repulsión.
Estas fuerzas son las más débiles que se dan entre moléculas en la naturaleza: se requiere apenas 0,1 a 35 kJ/mol de energía para vencerlas. Sin embargo, son cruciales para la formación de proteínas.
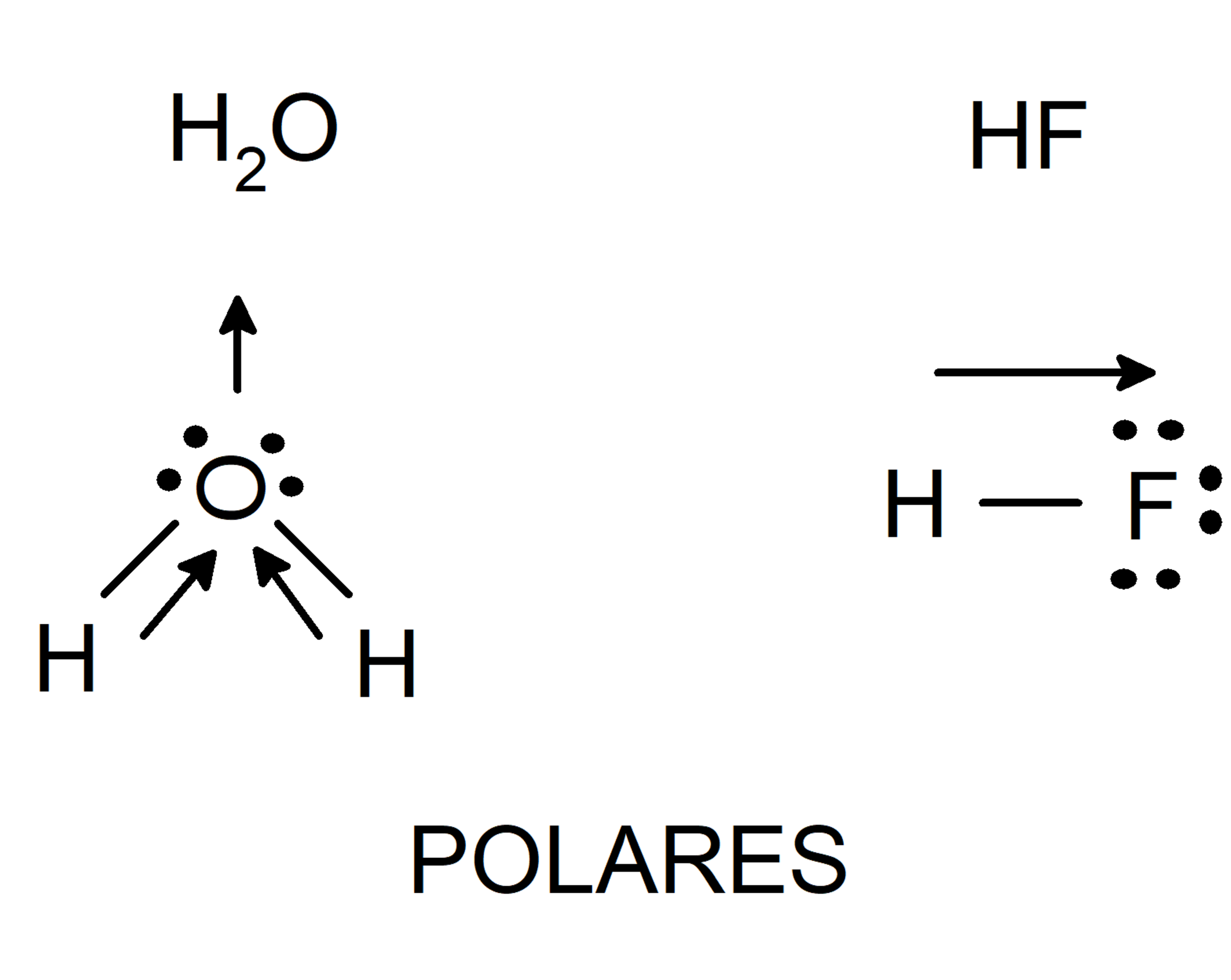

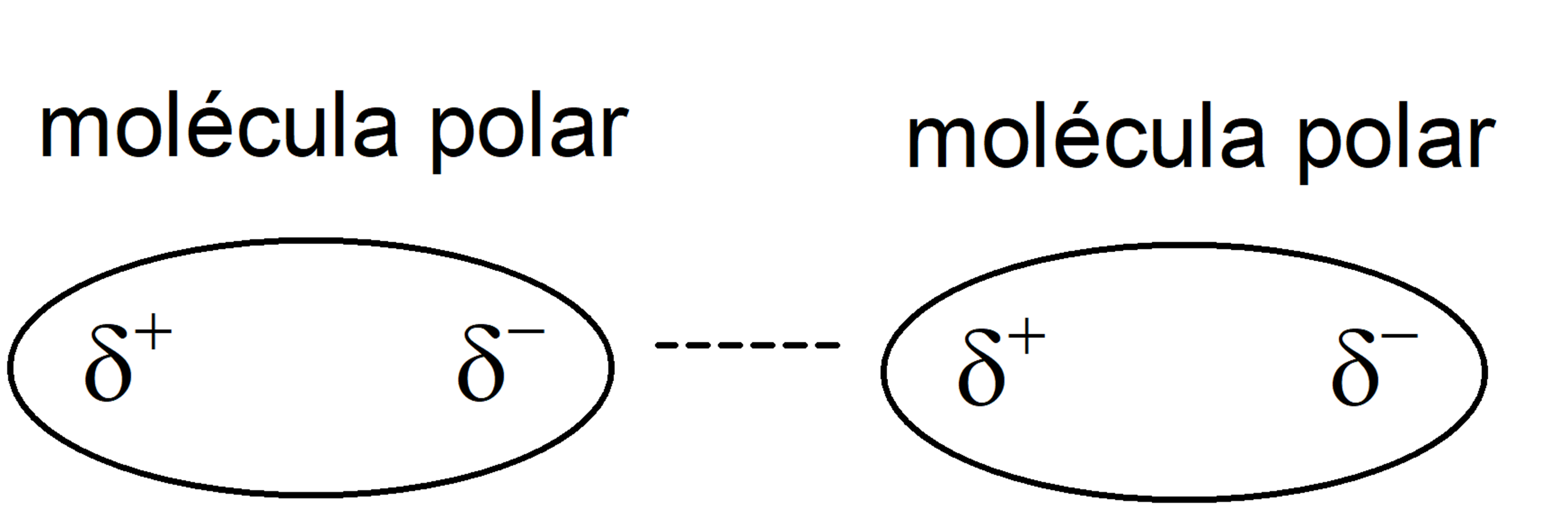

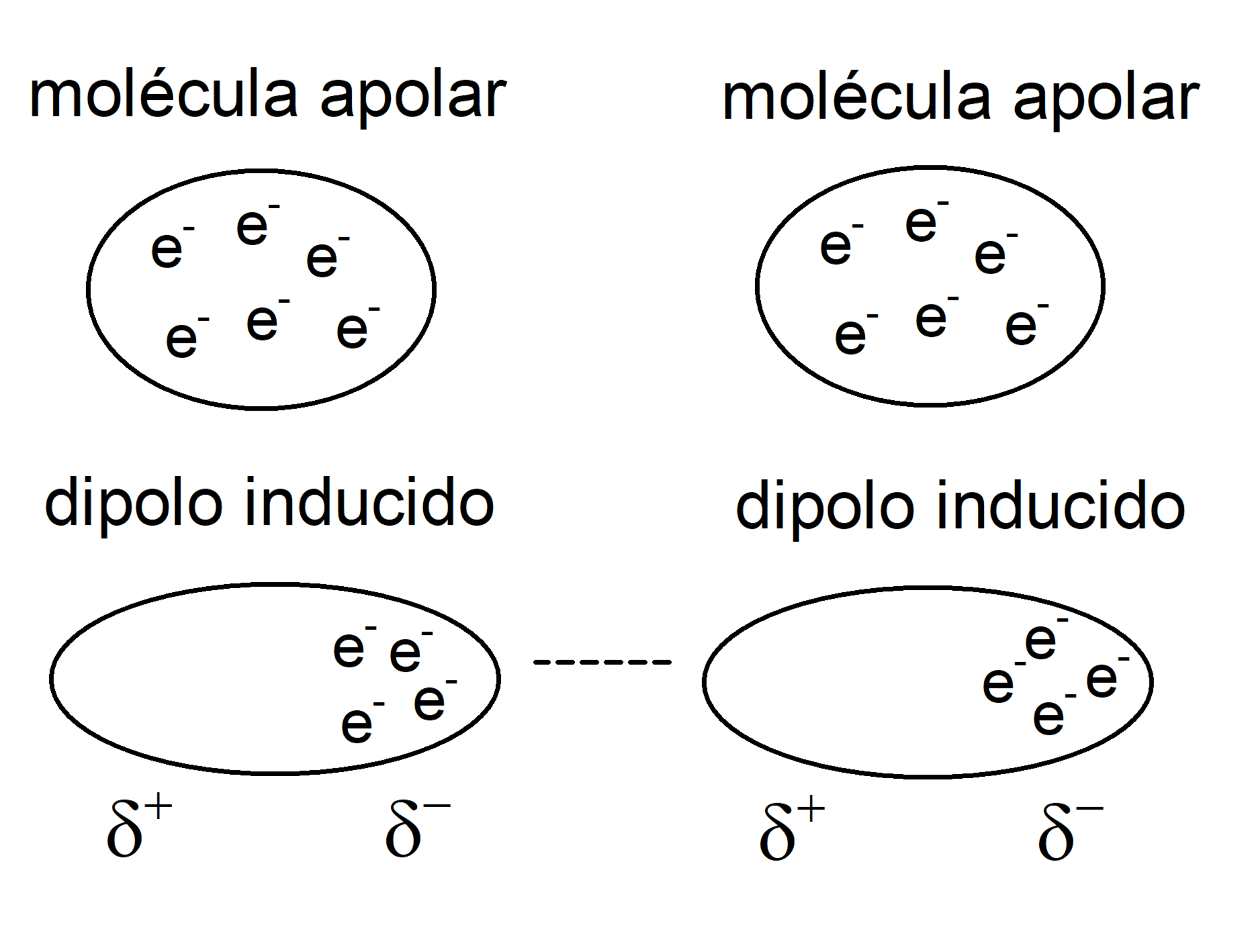
¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)