Te explicamos qué es el punto de ebullición y cómo se calcula. Ejemplos de punto de ebullición. Punto de fusión y de congelación.

¿Qué es el punto de ebullición?
El punto de ebullición es la temperatura a la cual la presión de vapor del líquido (presión que ejerce la fase gaseosa sobre la fase líquida en un sistema cerrado a determinada temperatura) se iguala a la presión que rodea al líquido. Al ocurrir esto, el líquido se transforma en gas.
El punto de ebullición es una propiedad que depende fuertemente de la presión ambiental. Un líquido sometido a una presión muy alta tendrá un punto de ebullición más alto que si lo sometemos a presiones más bajas, es decir, tardará más en pasar al vapor cuando está sometido a altas presiones. Debido a estas variaciones del punto de ebullición, la IUPAC definió el punto de ebullición estándar: es la temperatura a la cual un líquido se convierte en vapor a la presión de 1bar.
Una cuestión importante es que el punto de ebullición de una sustancia no se puede aumentar indefinidamente. Cuando aumentamos la temperatura de un líquido hasta pasar su punto de ebullición y aún así seguimos aumentándola, llegamos hasta una temperatura llamada “temperatura crítica”. La temperatura crítica es la temperatura por encima de la cual el gas no podrá ser transformado en líquido por aumento de presión, o sea, no se puede licuar. A esta temperatura, no existe una fase líquida o una fase vapor definida.
El punto de ebullición es diferente para cada sustancia. Esta propiedad depende de la masa molecular de la sustancia y del tipo de fuerzas intermoleculares que presente (puentes de hidrógeno, dipolo permanente, dipolo inducido), lo cual a su vez depende de si la sustancia es covalente polar o covalente apolar (no polar).
Cuando la temperatura de una sustancia está por debajo de su punto de ebullición, solo una parte de sus moléculas ubicadas en su superficie tendrá energía suficiente para romper la tensión superficial del líquido y escapar a la fase vapor. Por otra parte, cuando se suministra calor al sistema, se produce un aumento de la entropía del sistema (tendencia al desorden de las partículas del sistema).
Ver además: Propiedades de la materia
¿Cómo se calcula el punto de ebullición?
Mediante la ecuación de Clausius-Clapeyron se pueden caracterizar las transiciones de fase de un sistema compuesto por un solo componente. Esta ecuación se puede utilizar para calcular el punto de ebullición de las sustancias y se aplica de la siguiente forma:
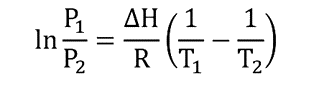
Donde:
P1 es la presión igual a 1 bar, o en atmósferas (0,986923 atm)
T1 es la temperatura de ebullición (punto de ebullición) del componente, medida a la presión de 1 bar (P1) y expresada en grados Kelvin (K).
P2 es la presión de vapor del componente expresada en bar o en atm.
T2 es la temperatura del componente (expresada en grados Kelvin) a la que se mide la presión de vapor P2.
𝚫H es la variación de entalpía de vaporización promedio en el rango de temperaturas que se está haciendo el cálculo. Se expresa en J/mol o unidades equivalentes de energía.
R es la constante de los gases equivalente a 8,314 J/Kmol
ln es el logaritmo natural
Se despeja la temperatura de ebullición (punto de ebullición) T1
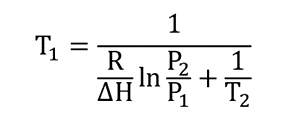
Ejemplos de punto de ebullición
Algunos puntos de ebullición registrados y conocidos en condiciones normales de presión (1 atm) son los siguientes:
- Agua: 100 ºC
- Helio: -268,9 ºC
- Hidrógeno: -252,8 ºC
- Calcio: 1484 ºC
- Berilio: 2471 ºC
- Silicio: 3265 ºC
- Carbono en forma de grafito: 4827 ºC
- Boro: 3927 ºC
- Molibdeno: 4639 ºC
- Osmio: 5012 ºC
- Wolframio: 5930 ºC
Punto de fusión

La temperatura a la que un sólido se transforma en líquido se denomina punto de fusión y durante la transición de fase sólido-líquido se mantiene constante la temperatura. En este caso, se le suministra calor al sistema hasta que su temperatura aumente lo suficiente como para que el movimiento de sus partículas en la estructura sólida sea mayor, lo cual provoca que se separen y fluyan hacia la fase líquida.
El punto de fusión también depende de la presión y por lo general es igual al punto de congelación de la materia (en el que al enfriar lo suficiente un líquido se transforma en un sólido) para la mayoría de las sustancias.
Sigue en: Punto de fusión
Punto de congelación
El punto de congelación es el contrario del punto de fusión, es decir, la temperatura a la cual un líquido se contrae, sus partículas pierden movimiento y adquieren una estructura más rígida, resistente a la deformación y con memoria de forma (única de las sustancias en estado sólido). Es decir, es la temperatura a la cual el líquido se transforma en sólido. La fusión requiere suministrar energía calórica al sistema, mientras que la congelación requiere retirar energía calórica (enfriar).
Por otra parte, el punto de congelación también depende de la presión. Un ejemplo es lo que ocurre al enfriar el agua hasta alcanzar una temperatura de 0 ºC a 1 atm, cuando esta se congela y se convierte en hielo. Si se enfría a una presión muy distinta de 1 atm, el resultado podría ser muy diferente, por ejemplo, si la presión es mucho más elevada, podría tardar en congelarse, pues su punto de congelación disminuye.
Punto de fusión y ebullición del agua
El agua se emplea a menudo como estándar a la hora de medir los puntos de fusión y ebullición de las sustancias. En líneas generales, a una presión normal, su punto de ebullición es de 100 ºC y el de fusión de 0 ºC (en el caso del hielo). Esto puede variar mucho en los casos en que el agua tenga otras sustancias disueltas en ella, líquidas o sólidas, como ocurre con el agua del mar, rica en sales, lo cual modifica sus propiedades físicas y químicas.
El impacto de la presión es también muy notorio. Se sabe que a 1 atm el punto de ebullición del agua es 100 ºC, pero llevándola a 0,06 atm nos sorprendería notar que la ebullición se produzca a los 0 ºC (en lugar de su congelamiento).
Referencias
- Manual pedagógico de prácticas de química general en microescala. Nemer, Beatriz Virginia Cervantes. Universidad Iberoamericana (2006). ISBN 978-968-859-594-7.
- «Punto de Ebullición» https://es.wikipedia.org/
¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)