Te explicamos qué es la destilación, ejemplos de este método de separación y los tipos de destilación que pueden utilizarse.

¿Qué es la destilación?
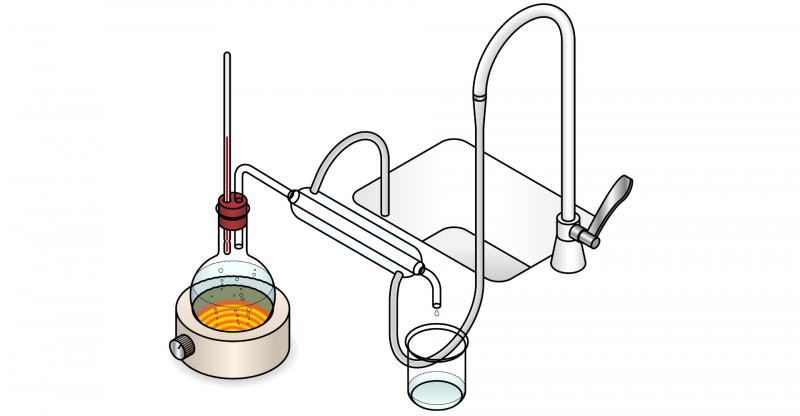
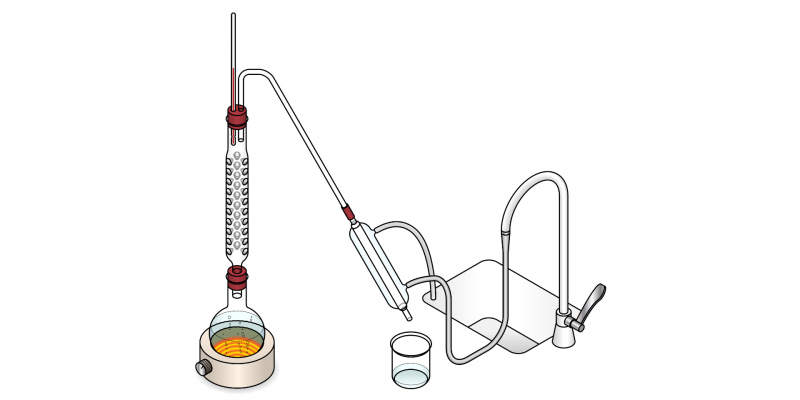
Se denomina destilación a un método de separación de fases, que se encuentra entre los métodos de separación de mezclas. La destilación consiste en el uso consecutivo y controlado de dos procesos físicos: la vaporización y la condensación, usándolas de manera selectiva para separar los componentes de una mezcla por lo general de tipo homogéneo, es decir, en la que no pueden distinguirse a simple vista sus componentes.
Las mezclas que pueden ser separadas en sus componentes individuales utilizando la destilación pueden contener dos líquidos, un sólido en un líquido o incluso gases licuados. Este método de separación se basa en la diferencia de puntos de ebullición (propiedad inherente de la materia, que es la temperatura a la que la presión de vapor de un líquido se iguala a la presión que rodea al líquido) de las distintas sustancias. Pasará primero a la fase vapor la sustancia que menor punto de ebullición tenga, luego esta sustancia se condensará en otro recipiente, y quedará relativamente pura.
De este modo, para que la destilación se lleve a cabo correctamente, deberemos hervir la mezcla hasta alcanzar el punto de ebullición de una de las sustancias integrantes, que entonces pasará a ser vapor y podrá ser conducido hasta un recipiente enfriado, en el que se condensa y se transforma en líquido nuevamente.
La otra sustancia integrante, en cambio, permanecerá en el recipiente sin alteraciones; pero en ambos casos tendremos sustancias puras, libres de la mezcla inicial.
Puede servirte: Filtración
Ley de Raoult
Cuando tenemos una mezcla ideal de líquidos (mezcla en la que las interacciones entre las partículas diferentes se consideran iguales a las interacciones entre partículas iguales) se cumple la Ley de Raoult.
Esta ley establece que la presión de vapor parcial de cada componente en la mezcla gaseosa es igual a la presión de vapor del componente puro multiplicada por su fracción molar en la mezcla líquida.
La presión de vapor total es, entonces, la suma de las presiones parciales de los componentes de la mezcla en la fase gaseosa. Por otra parte, la fracción molar de un componente en una mezcla es una medida adimensional de su concentración. Las magnitudes mencionadas anteriormente se pueden calcular utilizando las siguientes ecuaciones: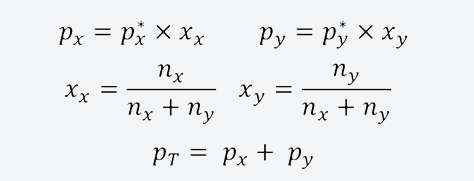
Donde:
- px y py son las presiones parciales de los componentes x e y respectivamente en la mezcla de vapores que rodea a la mezcla líquida.
- px* y py* son las presiones de vapor de los componentes x e y.
- xx y xy son las fracciones molares de los componentes x e y en la mezcla líquida.
- nx y ny son la cantidad de sustancia de los componentes x e y en la mezcla líquida.
La Ley de Raoult planteada anteriormente es válida para mezclas ideales (que son un modelo establecido por el ser humano para simplificar los estudios), pero en la realidad esta ley sufre desviaciones cuando la mezcla es real.
Así, si las diferentes partículas de la mezcla tienen fuerzas intermoleculares más fuertes que las partículas en el líquido puro, entonces la presión de vapor de la mezcla es menor que la presión del vapor del líquido puro, lo que produce una desviación negativa de la Ley de Raoult.
Si, por otro lado, las fuerzas intermoleculares entre las partículas en el líquido puro son mayores que las de las partículas en la mezcla, las partículas en la mezcla podrán escapar a la fase vapor con mayor facilidad, por lo que la presión de vapor de la mezcla será mayor, produciendo una desviación positiva de la ley de Raoult
Cuando se quiere destilar una mezcla azeotrópica (por ejemplo, etanol y agua), es necesario agregar algún componente (benceno, en este caso) para que se modifique el azeótropo y de esta forma poder separar los componentes de la mezcla. Un azeótropo es un mezcla líquida con composición definida que cuando hierve, los vapores generados tienen la misma composición de la mezcla (por lo que no se pueden separar los componentes de la mezcla azeotrópica por destilación simple o fraccionada).
Los azeótropos tienen una temperatura de ebullición definida, por ejemplo, a una presión de 1 atm, el etanol hierve a 78,37 °C y el agua hierve a 100 °C, mientras que el azeótropo etanol-agua hierve a 78,2 °C. Las mezclas azeotrópicas tienen desviaciones negativas o positivas de la Ley de Raoult según sea el caso.
Tipos de destilación
La destilación puede ocurrir de distintas formas:
- Destilación simple. La más elemental consiste en hervir la mezcla hasta separar los distintos componentes. Es un método de separación efectivo cuando los puntos de ebullición de los componentes de la mezcla difieren mucho, (lo ideal es que tengan una diferencia de al menos 25°C, de lo contrario, no garantiza la pureza total de la sustancia destilada).

- Destilación fraccionada. Se realiza mediante una columna de fraccionamiento, que está formada por diferentes placas en las que se produce sucesivamente la vaporización y la condensación, garantizando una mayor pureza en los componentes separados.

- Destilación al vacío. Disminuyendo la presión hasta generar vacío, se cataliza el proceso para reducir el punto de ebullición de los componentes, pues algunos tienen puntos de ebullición muy altos que pueden ser reducidos cuando se disminuye mucho la presión y lograr, de esta forma, acelerar el proceso de destilación.
- Destilación azeotrópica. Es la destilación necesaria para romper un azeótropo, o sea, una mezcla cuyas sustancias se comportan como una sola, incluso compartiendo el punto de ebullición, por lo que no se pueden separar por destilación simple o fraccionada. Para separar una mezcla azeotrópica es necesario modificar las condiciones de la mezcla, por ejemplo, añadiendo algún componente separador.
- Destilación por arrastre de vapor. Los componentes volátiles y no volátiles de una mezcla se separan mediante la inyección directa de vapor de agua.
- Destilación seca. Consiste en calentar materiales sólidos sin presencia de solventes líquidos, obtener gases y luego condensarlos en otro recipiente.
- Destilación mejorada. Llamada también destilación alterna o reactiva, se adapta a los casos específicos de mezclas difíciles de separar o que tienen un mismo punto de ebullición.
Ejemplos de destilación

- Refinación petrolera. La separación de los diversos hidrocarburos presentes en el petróleo se realiza mediante la destilación fraccionada, almacenando en diversas capas o compartimientos separados de una columna de destilación cada compuesto derivado de la cocción del petróleo crudo. Estos gases se elevan y condensan en capas superiores de la columna, mientras las sustancias más densas como el asfalto y la parafina permanecen en las capas inferiores.
- Cracking catalítico. Se llama así a determinadas destilaciones al vacío usuales en el procesado del petróleo, empleando torres de vacío para separar los gases de la cocción del crudo. Así se acelera la ebullición de los hidrocarburos y se apresura el proceso. El craqueo es un tipo de destilación destructiva, en la que los hidrocarburos de mayor tamaño se rompen (a altas temperaturas y empleando catalizadores) en hidrocarburos más pequeños, que tienen menor punto de ebullición.
- Purificación del etanol. Para separar alcoholes como el etanol del agua durante su obtención en el laboratorio, se emplea una destilación azeotrópica, agregando a la mezcla benceno u otros componentes que propician o aceleran la separación, y que pueden después ser removidos fácilmente sin alterar la composición química del producto.
- Procesamiento del carbón. Para obtener combustibles orgánicos líquidos, se emplea el carbón o la madera mediante procedimientos de destilación en seco, así se pueden condensar los gases emitidos en la combustión.
- Termólisis de sales minerales. Mediante destilación en seco se obtienen diversas sustancias minerales de alta utilidad industrial, a partir de la emanación y condensación de gases obtenidos al quemar sales minerales.
- El alambique. Se llama así al aparato inventado en la antigüedad árabe, cuyo propósito es producir perfumes, medicinas y alcohol a partir de frutas fermentadas. En su funcionamiento se emplean los principios de la destilación: se calientan sustancias en una pequeña caldera y se enfrían los gases producidos en un serpentín que conduce a otro recipiente donde se recolecta el líquido producido por la condensación de dichos gases.
- Producción de perfumes. La destilación por arrastre de vapor se emplea en la obtención de perfumes, hirviendo agua junto con flores conservadas, para producir un gas con el olor deseado y que luego, al condensarse, puede ser empleado como líquido de base en los perfumes.
¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)