Te explicamos qué es la combustión, cómo se produce y cuáles son las etapas de la reacción. Además, clasificación y ejemplos.
¿Qué es la combustión?
La combustión es un tipo de reacción química exotérmica. Puede involucrar materia en estado gaseoso o en estado heterogéneo (líquido-gaseoso o sólido-gaseoso). Genera luz y calor en la mayoría de los casos, y se produce de manera considerablemente rápida.
Tradicionalmente, la combustión se entiende como un proceso de oxidación rápido de ciertos elementos combustibles, o sea, constituidos principalmente por hidrógeno, carbono y a veces azufre. Además, necesariamente tiene lugar en presencia de oxígeno.
En realidad, las combustiones son reacciones redox (reducción-oxidación) que se pueden producir tanto de manera controlada, como en los motores de combustión interna, o descontrolada, como en las explosiones. Estas reacciones, implican intercambio de electrones entre los átomos de la materia durante la reacción.
Casi siempre, las combustiones generan energía térmica y lumínica y además producen otras sustancias gaseosas y sólidas, como el dióxido de carbono (CO2) y el vapor de agua, o los residuos sólidos del combustible (la sustancia consumida en la reacción) y del comburente (la sustancia que propicia la reacción). Las sustancias generadas dependen de la naturaleza química de los reactivos involucrados en la combustión.
De este modo, aunque en la imagen tradicional de la combustión haya siempre fuego involucrado, es posible que no se genere fuego, dado que no es más que una forma de plasma (gas ionizado) producto de la liberación de calor de la reacción química de combustión, que para formarse depende de las condiciones y reactivos de cada reacción específica.
Ver también: Entalpía
¿Cómo se produce la combustión?
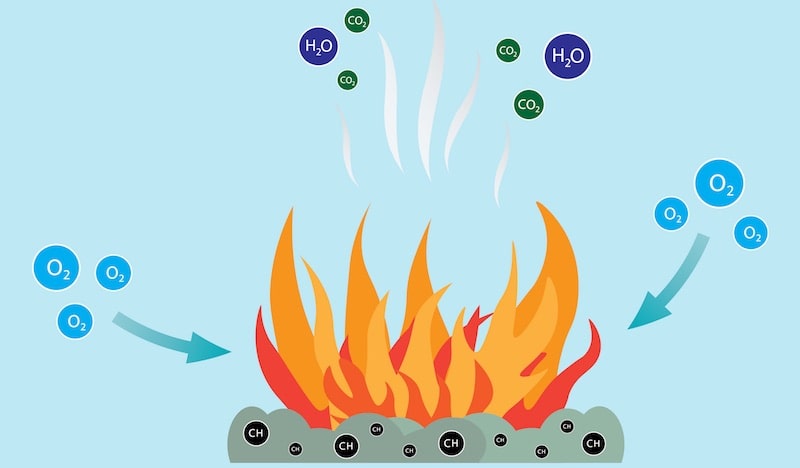
Las combustiones son un tipo de reacción redox, es decir, una reacción de reducción-oxidación. Esto significa que en ellas un reactivo se oxida (pierde electrones), mientras que el otro se reduce (gana electrones).
En el caso de la combustión, el agente oxidante (oxígeno) obtiene electrones del agente reductor (combustible), o lo que es lo mismo, el comburente (oxígeno), obtiene electrones del combustible. Esto se da generalmente según la siguiente fórmula:
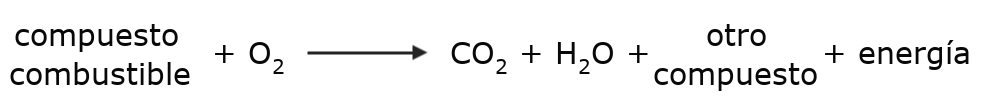
Los compuestos combustibles pueden variar en cada reacción de combustión, según sea su naturaleza, así como pueden variar los niveles de energía generada. Pero el dióxido de carbono y el agua se producen de alguna manera en todas las combustiones.
Tipos de combustión
Existen tres tipos de combustión:
- Combustiones completas o perfectas. Son aquellas reacciones en las que se oxida (consume) totalmente el material combustible y se producen otros compuestos oxigenados, como el dióxido de carbono (CO2) o dióxido de azufre (SO2), según sea el caso, y agua (H2O).
- Combustiones estequiométricas o neutras. Se denomina así a las combustiones completas ideales, que emplean las cantidades justas de oxígeno para su reacción y que ocurren, por lo general, únicamente en el ambiente controlado de un laboratorio.
- Combustiones incompletas. Son aquellas reacciones en que aparecen compuestos que no se oxidaron completamente (llamados también inquemados) en los gases de combustión. Tales compuestos pueden ser monóxido de carbono (CO), hidrógeno, partículas de carbono, etcétera.
Reacción de combustión
Los procesos de combustión comprenden en realidad un conjunto de reacciones químicas rápidas y que ocurren de forma simultánea. A cada una de estas reacciones se les puede llamar etapa o fase. Las tres etapas fundamentales de la combustión son:
- Pre-reacción o primera etapa. Los hidrocarburos presentes en el material combustible se descomponen y comienzan su reacción con el oxígeno del aire, formando radicales (compuestos inestables molecularmente). Esto inicia una reacción en cadena de aparición y desaparición de compuestos químicos donde, por lo general, se forman más compuestos de los que se descomponen.
- Oxidación o segunda etapa. En esta etapa se genera la mayor parte de la energía calórica de la reacción. A medida que el oxígeno reacciona con los radicales de la etapa anterior, se va generando un proceso de desplazamiento violento de electrones. En el caso de las explosiones, un número elevado de radicales conduce a una reacción masiva y violenta.
- Fin de la reacción o tercera etapa. Ocurre cuando se completa la oxidación de los radicales y se forman las moléculas estables que serán los productos de la combustión.
Ejemplos de combustión

Algunos ejemplos simples de combustión en la vida cotidiana son:
- El encendido de un fósforo/cerilla. Es el caso más emblemático de combustión. Cuando la cabeza del fósforo (cubierta de fósforo y azufre) se raspa contra una superficie rugosa, se calienta por la fricción y desencadena una combustión rápida, que a su vez produce una llama breve.
- El encendido de una cocina a gas. Las cocinas domésticas funcionan mediante la combustión de un gas hidrocarburo, generalmente mezcla de propano (C3H8) y butano (C4H10), que el artefacto extrae de una cañería o de un recipiente. Puesto en contacto con el aire y provisto de una carga inicial de energía calórica (como la llama del piloto, o la de un fósforo), el gas inicia su reacción; pero para mantener la llama encendida, debe suministrarse combustible continuamente.
- Las bases fuertes y la materia orgánica. La mayoría de las bases fuertes (hidróxidos) como la soda cáustica, la potasa cáustica y otras sustancias de pH básico extremo, generan reacciones de oxidación violenta al entrar en contacto con la materia orgánica. Esto significa que podemos quemarnos por contacto con estas sustancias e incluso iniciar incendios con ellas, dado que estas reacciones suelen ser muy exotérmicas.
- Los motores de combustión interna. Estos artefactos están presentes en automóviles, lanchas y otros vehículos que operan con combustibles fósiles como gasoil, gasolina o keroseno. Son un ejemplo del uso de las combustiones controladas. En ellas se consumen los hidrocarburos del combustible y se generan pequeñas explosiones que, dentro del sistema de pistones, se transforman en movimiento, produciendo también gases contaminantes, que son liberados a la atmósfera.
Sigue con: Reacciones endotérmicas
Referencias
- “Combustión” https://es.wikipedia.org/
- “La combustión como proceso de transformación energética” en Ambientum, enciclopedia medioambiental. https://www.ambientum.com/
- “La combustión y tipos de combustión” http://www.expower.es/
- “The Combustion Process” en Auburn University. http://www.auburn.edu/
- “Combustion” https://www.grc.nasa.gov
- “Combustion (Chemical reaction)” https://www.britannica.com/
¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)