Te explicamos qué es el calor específico y cuáles son sus unidades. Además, las fórmulas que se utilizan para calcularlo y algunos ejemplos.
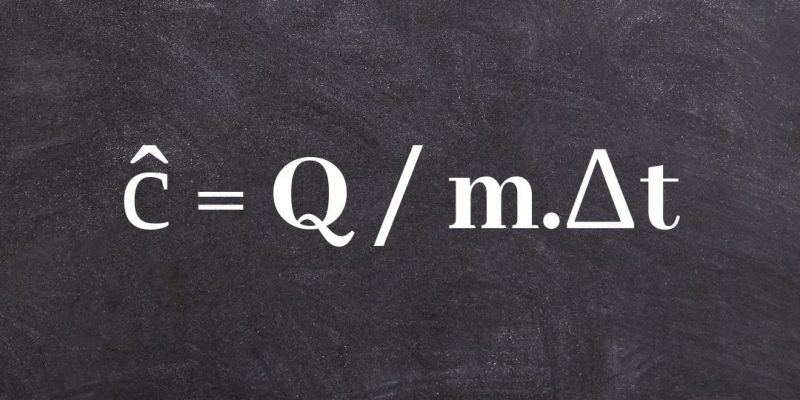
¿Qué es calor específico?
En física, se entiende por calor específico (también llamado capacidad térmica específica o capacidad calórica específica) a la cantidad de calor que se requiere para que una unidad de una sustancia incremente su temperatura en una unidad de grado Celsius.
El calor específico varía de acuerdo al estado físico de la materia, es decir, es distinto si la materia se encuentra en estado sólido, líquido o gaseoso porque su particular estructura molecular incide en la transmisión del calor dentro del sistema de partículas. Lo mismo ocurre con las condiciones de presión atmosférica: a mayor presión, menor calor específico.
Ver además: Propiedades de la materia
Unidades del calor específico
Dado que en el Sistema Internacional de mediciones la unidad para el calor son los joules (J), el calor específico se expresa en este sistema en joules por kilogramo y por kelvin (J.Kg-1.K-1).
Otra forma común de medición implica el uso de la caloría por gramo y por grado centígrado (cal.g-1.°C-1), y en los países o los ámbitos que emplean el sistema anglosajón, se lo mide con BTU’s por libra y por grado Fahrenheit. Estos dos últimos, por fuera del SI.
Fórmulas de calor específico
La fórmula más usual para calcular el calor específico de una sustancia es:
ĉ = Q / m.Δt
donde Q representa la transferencia de energía calórica entre el sistema y su entorno, m la masa del sistema y Δt la variación de temperatura al cual se lo somete.
Así, el calor específico (c) a una temperatura dada (T) se calculará de la siguiente forma:
c = lim (Δt→0) . Q / m.ΔT = 1/m . dQ/dT
Cuanto mayor es el calor específico de una sustancia frente a cierto suministro de calor, su temperatura variará menos. Por ejemplo, preferimos usar una cuchara de madera para cocinar y no una de aluminio ya que el calor específico de la madera es considerablemente mayor al del aluminio.
Puede servirte: Transferencia de calor
Ejemplos de calor específico

Un ejemplo sencillo del calor específico es el del agua. Se requiere de una caloría para aumentar un grado Celsius un gramo de agua a temperatura ambiente, es decir, el calor específico del agua es 1 cal.g-1.° C-1 . Por otro lado, se requieren 0,5 calorías para aumentar en un grado la temperatura del hielo a -5 °C.
El agua es la sustancia común con mayor calor específico y por eso cumple un papel muy importante en la regulación de la temperatura del planeta.
Otros registros de calor específico son:
- Aluminio. 0,215 calorías por gramo por grado Celsius
- Cobre. 0,0924 calorías por gramo por grado Celsius
- Oro. 0,0308 calorías por gramo por grado Celsius
- Hierro. 0,107 calorías por gramo por grado Celsius
- Silicio. 0,168 calorías por gramo por grado Celsius
- Potasio. 0,019 calorías por gramo por grado Celsius
- Vidrio. 0,2 calorías por gramo por grado Celsius
- Mármol. 0,21 calorías por gramo por grado Celsius
- Madera. 0,41 calorías por gramo por grado Celsius
- Alcohol etílico. 0,58 calorías por gramo por grado Celsius
- Mercurio. 0,0033 calorías por gramo por grado Celsius
- Aceite de oliva. 0,47 calorías por gramo por grado Celsius
¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)