Te explicamos qué es la regla del octeto en química, quién fue su creador, ejemplos y excepciones. Además, la estructura de Lewis.
¿Qué es la regla del octeto?
En química, se conoce como la regla del octeto o teoría del octeto a la explicación sobre la forma en que los átomos de los elementos químicos se combinan.
Esta teoría fue enunciada en 1917 por el físico químico estadounidense Gilbert N. Lewis (1875-1946) y explica que los átomos de los distintos elementos suelen mantener siempre una configuración electrónica estable mediante la ubicación de ocho electrones en sus últimos niveles de energía.
La regla del octeto establece que los iones de los distintos elementos químicos que se encuentran en la Tabla Periódica suelen completar sus últimos niveles de energía con 8 electrones. Debido a esto, las moléculas pueden adquirir una estabilidad semejante a la de los gases nobles (ubicados al extremo derecho de la tabla periódica), cuya estructura electrónica (con su último nivel de energía completo) los hace muy estables, o sea, poco reactivos.
Así, los elementos de alta electronegatividad (como los halógenos y anfígenos, es decir, elementos del grupo 16 de la Tabla) tienden a “ganar” electrones hasta alcanzar el octeto, mientras que los de baja electronegatividad (como los alcalinos o alcalinotérreos) tienden a “perder” electrones para alcanzar el octeto.
Esta regla explica una de las maneras en que los átomos forman sus enlaces, y de la naturaleza de estos dependerá el comportamiento y las propiedades químicas de las moléculas resultantes. De este modo, la regla del octeto es un principio práctico que sirve para predecir el comportamiento de muchas sustancias, si bien presenta también distintas excepciones.
Ver también: Enlace covalente
Ejemplos de la regla del octeto
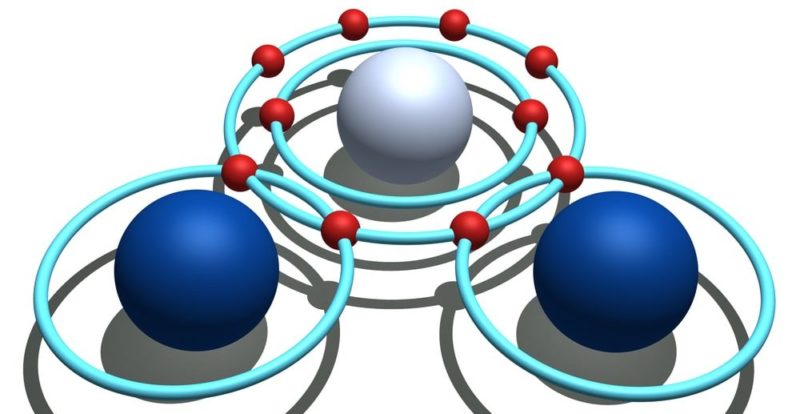
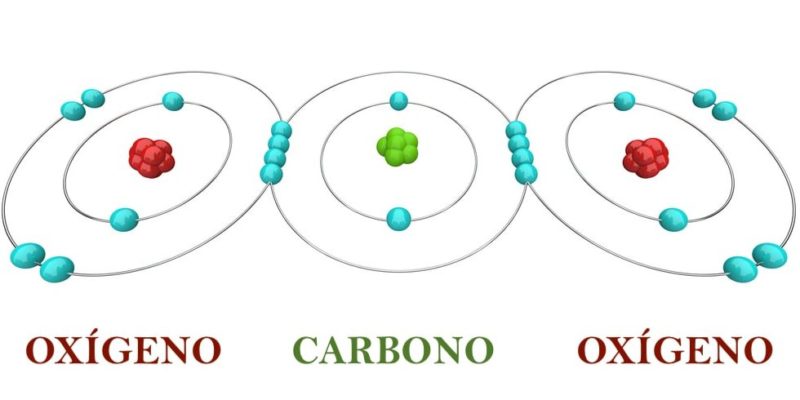
Pensemos en una molécula de CO2 cuyos átomos presentan valencias de 4 (carbono) y 2 (oxígeno), unidos por enlaces químicos dobles. (Es importante aclarar que la valencia son los electrones que debe ceder o aceptar un elemento químico para lograr que su último nivel de energía quede completo. No se debe confundir la valencia química con los electrones de valencia, pues estos últimos son los electrones que se encuentran ubicados en el último nivel de energía).
Esta molécula es estable si cada átomo presenta 8 electrones en total en su último nivel de energía, alcanzando el octeto estable, lo que se cumple con el compartimiento de 2 electrones entre el carbono y los átomos de oxígeno:
- El carbono comparte dos electrones con cada oxígeno, aumentando desde 6 hasta 8 los electrones en el último nivel de energía de cada oxígeno.
- Al mismo tiempo, cada oxígeno comparte dos electrones con el carbono, aumentando desde 4 hasta 8 los electrones en el último nivel de energía del carbono.
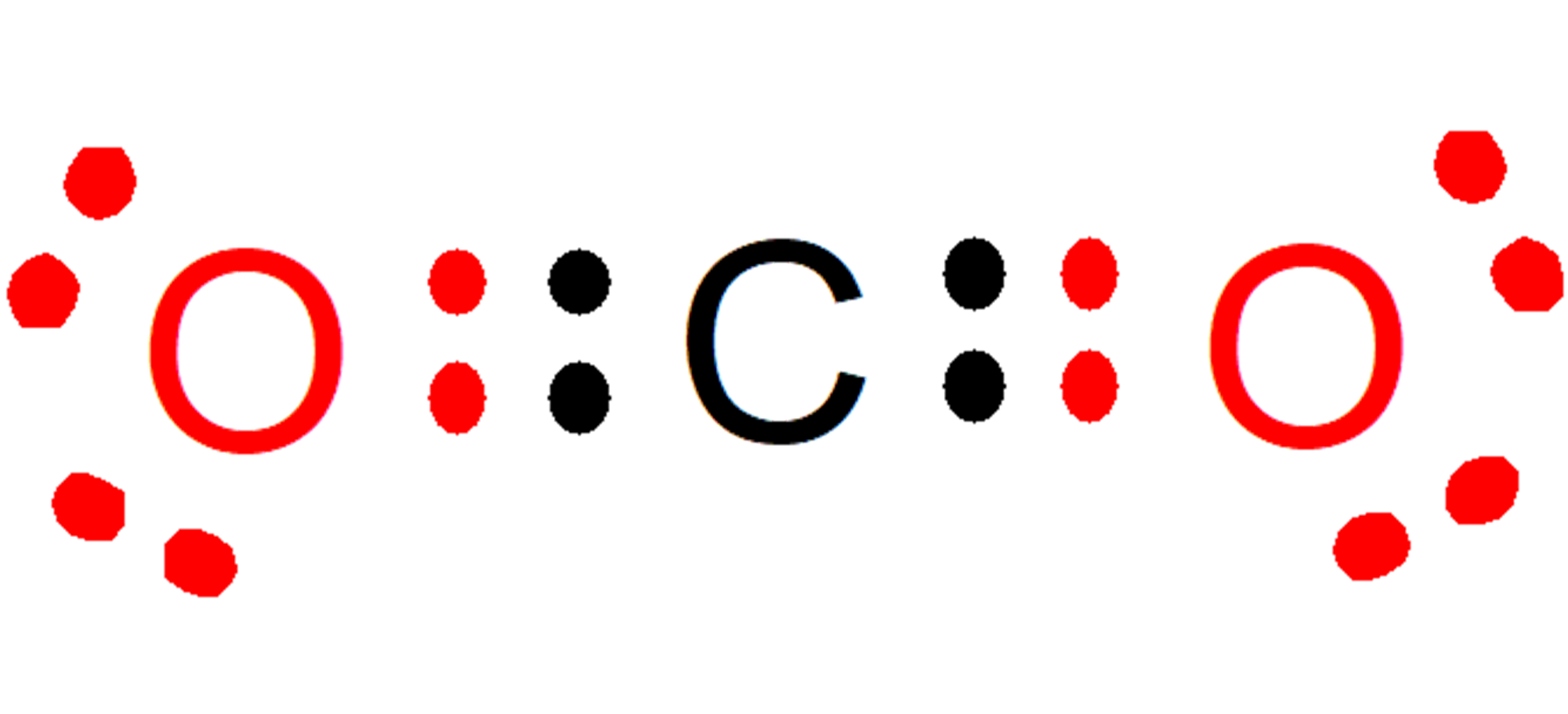
Otra forma de verlo sería que el total de los electrones cedidos y tomados debe ser siempre ocho.
Ese es el caso de otras moléculas estables, como el cloruro de sodio (NaCl). El sodio aporta su único electrón (valencia 1) al cloro (valencia 7) para completar el octeto. Así, tendríamos Na1+Cl1- (o sea, el sodio cedió un electrón, y ganó una carga positiva, y el cloro aceptó un electrón y con él una carga negativa).
Excepciones a la regla del octeto
La regla del octeto tiene varias excepciones, o sea, compuestos que alcanzan su estabilidad sin regirse por el octeto de electrones. Átomos como el fósforo (P), azufre (S), selenio (Se), silicio (Si) o helio (He) pueden alojar más electrones de lo sugerido por Lewis (hipervalencia).
Por el contrario, el hidrógeno (H), que posee un único electrón en un único orbital atómico (región del espacio donde es más probable encontrar un electrón en torno al núcleo atómico), puede aceptar hasta dos electrones como máximo en un enlace químico. Otras excepciones lo constituyen el berilio (Be), que adquiere estabilidad con apenas cuatro electrones, o el boro (B), que lo hace con seis.
Regla del octeto y estructura de Lewis
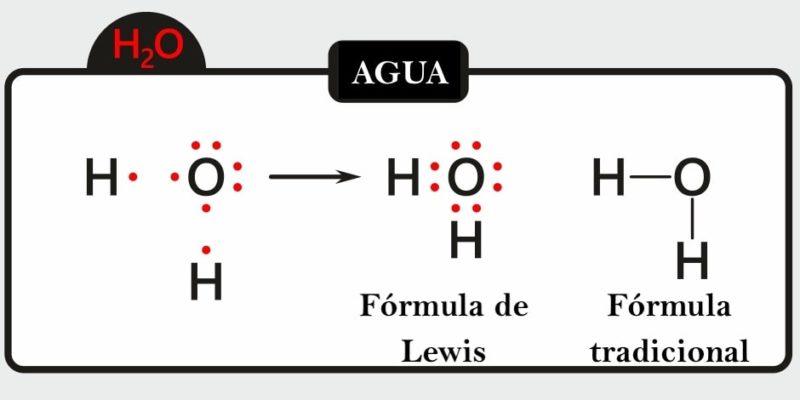
Otro de los grandes aportes de Lewis a la química fue su célebre forma de representar las uniones atómicas, hoy conocida como “estructura de Lewis” o “fórmula de Lewis”.
Consiste en colocar puntos o guiones para representar los electrones compartidos en una molécula y los electrones que queden libres sobre cada átomo.
Este tipo de representación gráfica bidimensional permite saber la valencia de un átomo que interactúa con otros en un compuesto y si forma enlaces simples, dobles o triples, todo lo cual incidirá en la geometría molecular.
Para representar una molécula de este modo necesitamos elegir un átomo central, que será rodeado por los demás (llamados terminales) estableciendo enlaces hasta alcanzar las valencias de todos los involucrados. Los primeros suelen ser los menos electronegativos y los segundos los más electronegativos.
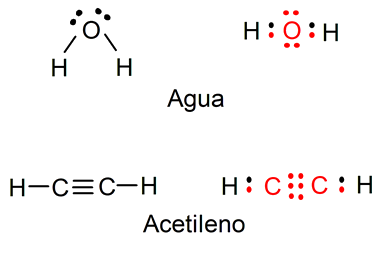
Por ejemplo, la representación del agua (H2O) muestra los electrones libres que tiene el átomo de oxígeno, además se pueden visualizar los enlaces simples entre el átomo de oxígeno y los átomos de hidrógeno (los electrones que pertenecen al átomo de oxígeno están representados en color rojo y los de los átomos de hidrógeno en color negro). También se representa la molécula de acetileno (C2H2), donde se puede visualizar el enlace triple entre los dos átomos de carbono y los enlaces simples entre cada átomo de carbono y un átomo de hidrógeno (los electrones que pertenecen a los átomos de carbono están representados en color rojo y los de los átomos de hidrógeno en color negro).
Sigue con: Oxidación
Referencias
- “Regla del octeto” https://es.wikipedia.org/
- “Regla del octeto” (video) Oakademia – Estudiar online y cuando quieras. https://www.youtube.com/
- “Regla del octeto” https://quimica.laguia2000.com/
- “¿Qué es la regla del octeto?” https://www.tplaboratorioquimico.com/
¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)