Te explicamos qué son los gases nobles, cómo se descubrieron, cuáles son sus usos, aplicaciones, otras características y ejemplos.

¿Qué son los gases nobles?
En química, se denomina gases nobles o gases inertes a un conjunto de elementos químicos que conforman el grupo 18 (VIIIA) de la Tabla Periódica de los elementos.
Su principal característica en común es su bajísimo grado de reactividad química, o sea, su poca propensión a formar moléculas y compuestos con otros elementos. De hecho, existe únicamente un pequeño conjunto de compuestos a partir de los gases nobles, a diferencia de la mayoría de los elementos conocidos que pueden formar una mayor cantidad de compuestos químicos.
En condiciones de temperatura y presión usuales, los gases nobles son sustancias gaseosas monoatómicas (o sea, conformadas por un solo átomo). Muchos de ellos se hallan presentes en diversa proporción en el aire que integra la atmósfera.
A pesar de su baja reactividad química, o a veces en consecuencia de ella, estos elementos tienen aplicaciones muy diversas en la industria, y suelen ser producidos masivamente.
Puede servirte: No metales
Descubrimiento de los gases nobles
La mayoría de los gases nobles se descubrieron durante el siglo XIX, como consecuencia de los estudios sobre el Sol de Pierre Janssen (francés, 1824-1907) y Joseph Norman Lockyer (británico, 1836-1920). Estos astrónomos descubrieron el helio, llamado así por la palabra griega (Helios) para el astro.
La sorpresa ante las propiedades tan características de este nuevo elemento abrió las puertas a la búsqueda de otros similares. Así se descubrió el kriptón, el neón y el argón, a partir del estudio químico del aire.
Hacia finales del siglo XIX los investigadores británicos Lord Rayleigh (1842-1919) y William Ramsay (1852-1916) postularon la existencia conjunta de los gases nobles, con lo cual obtuvieron el Premio Nobel de Física y Química. Recién en el siglo XX comenzó la producción industrial de estos gases a gran escala, conforme se descubrían más de sus propiedades y usos.
Características de los gases nobles

En general, los gases nobles se caracterizan por:
- Presentar poca o nula reactividad química, o sea, no reaccionan fácilmente. Esto se debe a que su última capa electrónica o nivel de energía se encuentra siempre completo.
- Estar desprovistos de color, olor y sabor.
- Presentar puntos de fusión y ebullición muy próximos y muy bajos, con apenas 10 ºC de diferencia, por lo que casi siempre están en estado gaseoso, aunque se pueden transformar a líquido solo en rangos de temperatura muy precisos.
- Comportarse como gases ideales en condiciones normales de presión y temperatura (1atm y 0 ºC.), es decir, se puede considerar que sus partículas no interactúan y cumplen con la ecuación de estado de los gases ideales:

Donde:
P. Representa la presión del gas y se expresa en atmósferas (atm) o unidades equivalentes.
V. Representa el volumen del gas y se expresa en litros (L) o unidades equivalentes.
n. Representa la cantidad de sustancia del gas y se expresa en moles (mol).
R. Es la constante de los gases ideales y tiene un valor de 8,314 joule/mol Kelvin (J/mol K).
T. Representa la temperatura del gas y se expresa en Kelvin (K) o unidades equivalentes. - En el caso del helio, presenta propiedades muy particulares: posee puntos de fusión y ebullición más bajos que cualquier sustancia conocida, es el único elemento que presenta superfluidez (estado del fluido que no presenta viscosidad, es decir, que fluye sin fricción), y no puede transformarse en sólido en condiciones de presión estándares.
¿Por qué se llaman gases nobles?
Inicialmente, a estos elementos se les bautizó “gases inertes” o “gases raros”, dado que se pensaba en la época que eran elementos totalmente inertes químicamente y, por lo tanto, muy raros en el universo. Ambas características resultaron ser falsas.
Hoy en día se prefiere “gases nobles”, traducción de “Edelgas”, término alemán con que el químico Hugo Erdmann (1862-1910) los bautizó en 1898. Erdmann tomó este nombre de los “metales nobles” como el oro, cuya reactividad es muy moderada. Entonces, así como el oro tendía a mantenerse puro y conservar su nobleza, también lo hacían estos gases.
Usos y aplicaciones de los gases nobles

Estos elementos poseen numerosas utilizaciones para el ser humano, tales como:
- Aislantes. Debido a su baja reactividad es posible usarlos para contener sustancias muy reactivas o peligrosas.
- Refrigerantes criogénicos. Mediante procesos que extraen calor y disminuyen la presión, se transforman los gases en líquidos, y estos líquidos son ideales para mantener andando maquinarias delicadas como imanes superconductores o equipos de resonancias magnéticas nucleares. Con este fin es muy utilizado el helio.
- Componente respirable. El helio mezclado con otros gases, se usa en los tanques de astronautas y buzos, ya que reduce el efecto narcótico del llamado “mal de profundidad”, que es causado por una alta concentración de gases en la sangre y tejidos. Como el helio tiene poca solubilidad, es menos probable que atraviese las membranas celulares.
- Relleno de globos inflables o dirigibles. El helio puede usarse para inflar globos ya que es más liviano que el aire y muy seguro, un perfecto reemplazo del hidrógeno, que es altamente inflamable.
- Iluminación. Puede usarse el neón, xenón, argón y kriptón, rellenando con ellos bombillas incandescentes para producir así colores específicos de luz, en lo que ordinariamente llamamos “luces de neón”.
- Para fabricar láseres. Se suelen emplear en cirugías o procedimientos industriales.
Ejemplos de gases nobles
Los gases nobles son solo siete:
- Helio (He). Es el segundo elemento más abundante del universo conocido. Una de las formas de obtenerlo es como producto de las reacciones de fusión de hidrógeno en el corazón de las estrellas. Tiene la peculiaridad de alterar la voz humana al ser inhalado y de ser mucho más liviano que el aire.
- Neón (Ne). Otro elemento abundante en el universo conocido. Se emplea para fabricar lámparas fluorescentes ya que les confiere un color rojo. Es particularmente usado en la fabricación de televisores. También es muy utilizado en la producción del láser He-Ne.
- Argón (Ar). Uno de los gases comunes en el aire que respiramos, es muy empleado como aislante industrial y en la obtención de láseres.
- Kriptón (Kr). Aunque es un gas noble, puede reaccionar con el flúor y con otras pocas sustancias de elevada electronegatividad, y posee seis isótopos estables y diecisiete isótopos radiactivos.
- Xenón (Xe). Es un gas muy pesado, presente tan solo en trazas en la atmósfera terrestre. Fue el primero de los gases nobles en ser sintetizado artificialmente.
- Radón (Rn). Resultado de la desintegración radiactiva de elementos como el radio o el actinio (por esa razón se le llamaba antes actinón), es un gas noble pero radiactivo, cuyo isótopo más estable puede durar un máximo de 3,8 días, antes de desintegrarse a polonio-218.
- Oganesón (Og). También llamado eka-emanation, ununoctio (Uuo) o elemento 118, este misterioso gas noble es altamente radiactivo y de origen sintético, o sea, que no existe en la naturaleza. Fue “descubierto” en 2002.
Sigue con: Modelos atómicos
Referencias
- “Gases nobles” https://es.wikipedia.org/
- “Tabla periódica #9. Grupo 18. Gases nobles” (video) en Cienciabit. https://www.youtube.com/
- “Gas noble” http://enciclopedia.us.es/
- “¿Qué tienen de nobles los gases nobles?” https://www.fisicanet.com.ar/
- “Noble gas” https://www.britannica.com/
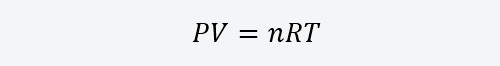
¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)