Te explicamos qué son los modelos atómicos, cuáles son y cuántos tipos hay. La historia de su evolución y características desde la Antigüedad hasta hoy.

¿Cuáles son los modelos atómicos?
Los modelos atómicos son distintas representaciones gráficas de la estructura y funcionamiento de los átomos. Fueron desarrollados a lo largo de la historia utilizando las ideas que se tenían sobre la composición de la materia.
Los modelos atómicos más importantes son los siguientes:
- Modelo atómico de Demócrito
- Modelo atómico de Dalton
- Modelo atómico de Thomson
- Modelo atómico de Lewis
- Modelo atómico de Rutherford
- Modelo atómico de Bohr
- Modelo atómico de Sommerfeld
- Modelo atómico de Schrödinger
- Modelo atómico actual
Los primeros modelos atómicos datan de la antigüedad clásica, cuando los filósofos y naturalistas se aventuraron a pensar y a deducir la composición de las cosas que existen, es decir, de la materia.
- Ver además: Átomo
Modelo atómico de Demócrito (450 a. C.)
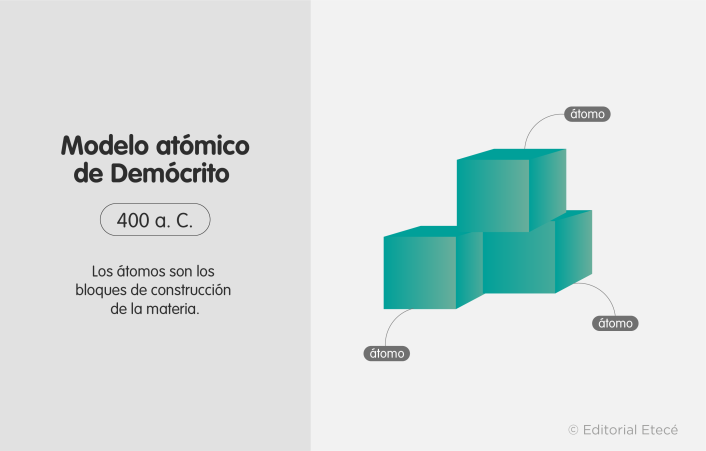
La “Teoría Atómica del Universo” fue creada por el filósofo griego Demócrito junto a su mentor, Leucipo. En aquella época, los conocimientos no se alcanzaban mediante la experimentación, sino mediante el razonamiento lógico, basándose en la formulación y el debate de ideas.
Demócrito propuso que el mundo estaba formado por partículas muy pequeñas e indivisibles, de existencia eterna, homogéneas e incompresibles, cuyas únicas diferencias eran de forma y tamaño, nunca de funcionamiento interno.
Según Demócrito, las propiedades de la materia estaban determinadas por el modo en que los átomos se agrupaban. Filósofos posteriores como Epicuro añadieron a la teoría el movimiento aleatorio de los átomos.
- Más en: Modelo atómico de Demócrito
Modelo atómico de Dalton (1803)

El modelo atómico de Dalton es el primer modelo atómico con bases científicas y fue propuesto por John Dalton en sus “Postulados Atómicos”, que plantean que:
- Todo está hecho de átomos, que son indivisibles e indestructibles.
- Los átomos de un mismo elemento químico son iguales entre sí, y tienen la misma masa e iguales propiedades.
- El peso atómico es el peso de cada elemento respecto al peso del hidrógeno.
- Los átomos no se dividen, ni cuando participan en reacciones químicas.
- Cuando se combinan átomos de dos o más elementos químicos, se forman compuestos químicos.
- Los átomos se combinan en relaciones simples para formar compuestos químicos.
- Los átomos de elementos químicos diferentes se pueden combinar de formas distintas para formar distintos compuestos químicos.
La teoría de Dalton tuvo algunos errores. Afirmaba que los compuestos químicos se formaban usando la menor cantidad de átomos posible de sus elementos.
Por ejemplo, la molécula de agua, según Dalton, sería HO y no H2O, que es la fórmula correcta. Por otro lado, decía que los elementos en estado gaseoso siempre eran monoatómicos (compuestos por un solo átomo), lo cual no es real, pues el oxígeno molecular, que es un gas, está formado por dos átomos de oxígeno (O2).
- Más en: Modelo atómico de Dalton
Modelo atómico de Thomson (1897)

Propuesto por J. J. Thomson, descubridor del electrón en 1897, el modelo atómico de Thomson es previo al descubrimiento de los protones y neutrones, por lo que asumía que los átomos estaban formados por una esfera de carga positiva y los electrones de carga negativa estaban incrustados en ella, como las pasas en el budín, razón por la cual se lo conoce como el “modelo del budín de pasas”.
Este modelo hacía una predicción incorrecta de la carga positiva en el átomo, pues afirmaba que esta estaba distribuida por todo el átomo. Más tarde esto fue corregido en el modelo de Rutherford donde se definió el núcleo atómico.
- Más en: Modelo atómico de Thomson
Modelo atómico de Lewis (1902)
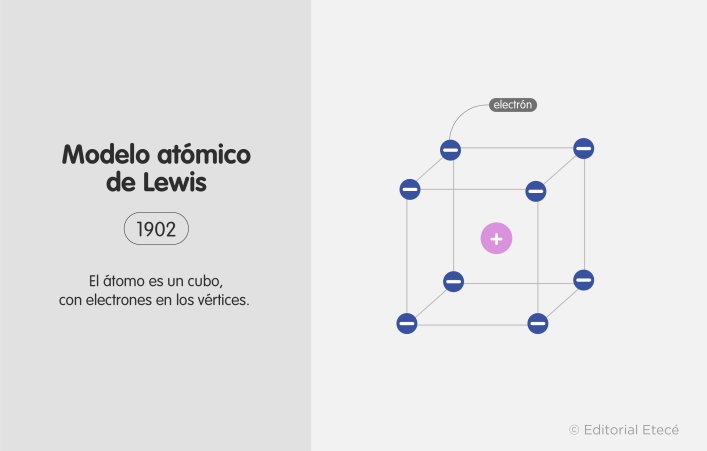
También llamado “modelo del átomo cúbico”, el modelo atómico de Lewis proponía la estructura del átomo como un cubo, en cuyos ocho vértices estaban los electrones. Esto permitió avanzar en el estudio de las valencias atómicas y los enlaces químicos, sobre todo luego de su actualización por parte de Irving Langmuir en 1919, que planteó el “átomo del octeto cúbico”.
Estos estudios fueron la base de lo que se conoce hoy como el diagrama de Lewis, que establece que en una molécula los electrones se representan como puntos y los enlaces covalentes como guiones o líneas. Este diagrama es una herramienta muy útil para explicar el enlace químico covalente.
- Más en: Modelo atómico de Lewis
Modelo atómico de Rutherford (1911)
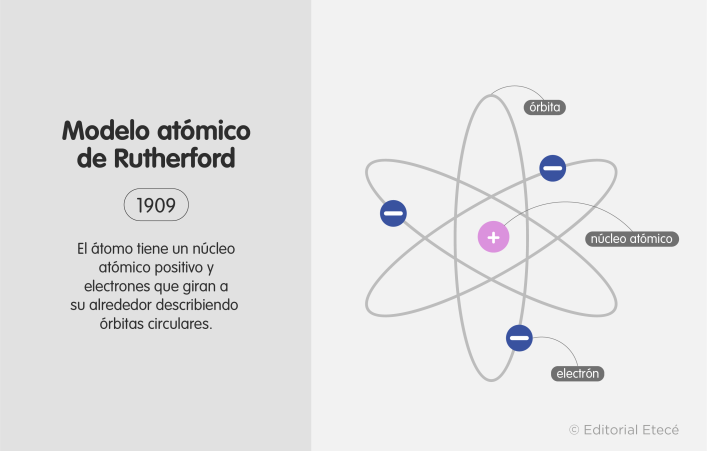
Ernest Rutherford realizó una serie de experimentos en 1911 a partir de láminas de oro. En estos experimentos determinó que el átomo está compuesto por un núcleo atómico de carga positiva (donde se concentra la mayor parte de su masa) y los electrones, que giran alrededor de este núcleo.
En este modelo se propone por primera vez la existencia del núcleo atómico.
- Más en: Modelo atómico de Rutherford
Modelo atómico de Bohr (1913)
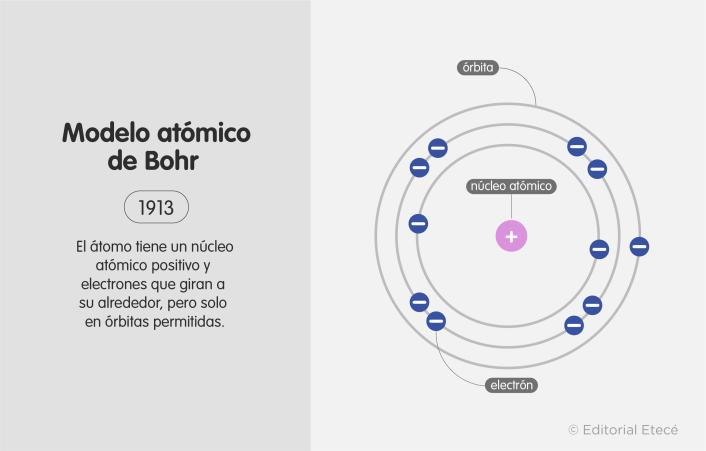
El modelo atómico de Bohr dio inicio en el mundo de la física a los postulados cuánticos, por lo que se considera una transición entre la mecánica clásica y la cuántica. El físico danés Niels Bohr propuso este modelo para explicar cómo podían los electrones tener órbitas estables (o niveles energéticos estables) rodeando el núcleo. Además, explica por qué los átomos tienen espectros de emisión característicos.
En los espectros realizados para muchos átomos se observaba que los electrones de un mismo nivel energético tenían energías diferentes. Esto demostró que había errores en el modelo y que debían existir subniveles de energía en cada nivel energético.
El modelo de Bohr se resume en tres postulados:
- Los electrones giran en órbitas circulares en torno al núcleo sin irradiar energía.
- Las órbitas permitidas a los electrones son aquellas con cierto valor de momento angular (L) (cantidad de rotación de un objeto) que sea un múltiplo entero del valor.
ℏ=h/2π
siendo h = 6.626 070 15 × 10-34 y 𝜋 = 3.1416.
- Los electrones emiten o absorben energía al saltar de una órbita permitida a otra órbita permitida y, al hacerlo, emiten un fotón que representa la diferencia de energía entre ambas órbitas.
- Más en: Modelo atómico de Bohr
Modelo atómico de Sommerfeld (1916)
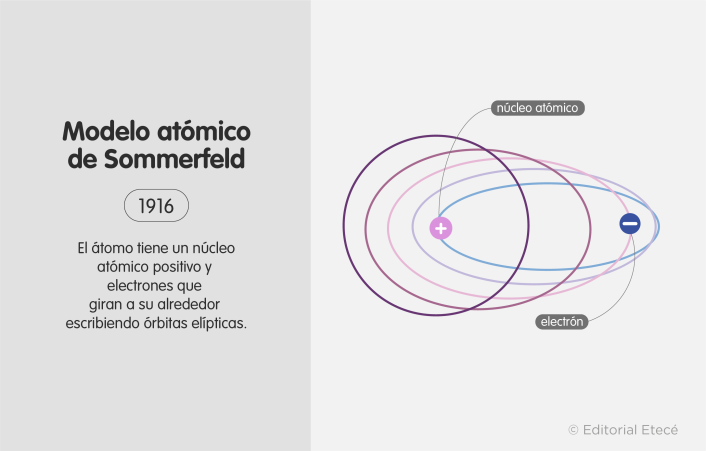
Este modelo fue propuesto por Arnold Sommerfield para intentar cubrir las deficiencias que presentaba el modelo de Bohr, especialmente para corregir la suposición de Bohr que plantea que los electrones describen órbitas circulares.
El modelo de Sommerfeld se basó en parte de los postulados relativistas de Albert Einstein.
Los postulados de este modelo son:
- Los electrones describen órbitas circulares y elípticas alrededor del núcleo.
- Existen subniveles de energía en cada nivel de energía del átomo.
- Los electrones representan corrientes eléctricas minúsculas.
- Más en: Modelo atómico de Sommerfeld
Modelo atómico de Schrödinger (1926)

El modelo atómico de Schrödinger, propuesto por Erwin Schrödinger a partir de los estudios de Bohr y Sommerfeld, concebía los electrones como ondas de materia, lo cual permitió la formulación posterior de una interpretación probabilística de la función de onda (magnitud que sirve para describir la probabilidad de encontrar a una partícula en el espacio) por parte de Max Born.
Eso significa que se puede estudiar probabilísticamente la posición de un electrón o su cantidad de movimiento, pero no ambas cosas a la vez, debido al Principio de Incertidumbre de Heisenberg.
Este es el modelo atómico vigente a inicios del siglo XXI, con algunas posteriores adiciones. Se le conoce como “Modelo cuántico-ondulatorio”.
Aun así, este modelo tiene algunas deficiencias, por ejemplo:
- Schrödinger no tiene en cuenta el espín electrónico (momento angular intrínseco de las partículas elementales).
- No tiene en cuenta los efectos relativistas de los electrones rápidos.
- No explica por qué un electrón en un nivel de energía superior, decae a un nivel de energía inferior.
- Más en: Modelo atómico de Schrödinger
Modelo atómico actual
El modelo atómico que se utiliza en la actualidad para representar la estructura y las propiedades del átomo está enmarcado en la mecánica cuántica no relativista, y se basa en el modelo propuesto por Schrödinger, en el espín electrónico y en el Principio de exclusión de Pauli, que plantea que dos electrones no pueden tener sus cuatro números cuánticos iguales.
Los electrones se consideran ondas de materia en el modelo atómico actual. Alrededor del núcleo atómico, los electrones están distribuidos en regiones llamadas orbitales atómicos, que se definen como las regiones donde es más probable encontrar un electrón alrededor del núcleo. Por otra parte, en este modelo, la energía y el momento angular del electrón no pueden tener cualquier valor, sino que solo pueden tomar valores permitidos, por lo que se dice que están cuantizados.
Utilizando la ecuación de Schrödinger se pueden predecir los valores de energía y momento angular asociados a un electrón, y el cuadrado de la función de onda asociada determina los orbitales atómicos.
Algunos postulados del modelo atómico actual son:
- El electrón se representa por su espín, su masa y su carga eléctrica negativa.
- El electrón tiene comportamiento onda-partícula.
- Las regiones permitidas para el electrón están determinadas por la función de onda, y el cuadrado de esta representa la probabilidad de encontrar a un electrón alrededor del núcleo.
- Un mismo estado representado por los números cuánticos n (número cuántico principal), l (número cuántico azimutal) y m (número cuántico magnético) puede estar ocupado solo por dos electrones, siempre que estos tengan espines contrarios. El espín es el cuarto número cuántico.
- Puede servirte: Estructura del átomo
Comparación entre los distintos modelos atómicos
Los modelos atómicos fueron evolucionando en el tiempo, y nuevos modelos se fueron desarrollando basándose en correcciones de los modelos anteriores.
| Modelo atómico | Año de propuesta | Descripción | Estructura del átomo |
|---|---|---|---|
| Modelo atómico de Demócrito | 400 a. C. | La materia está formada por partículas pequeñas e indivisibles llamadas átomos. | Átomos indivisibles, indestructibles y eternos. |
| Modelo atómico de Dalton | 1803 | Cada elemento está formado por átomos de un tipo único. | Átomos indivisibles, con una masa definida. |
| Modelo atómico de Thomson | 1897 | Los átomos tienen la carga positiva distribuida en toda su estructura. | Átomos descritos como una esfera positiva con electrones distribuidos en ella, similares a un pudín con pasas. |
| Modelo atómico de Lewis | 1902 | Los enlaces químicos covalentes se forman cuando dos cubos comparten sus aristas. Este modelo influye mucho en la descripción del enlace químico. | Átomos descritos como un cubo con los electrones ubicados en sus vértices. |
| Modelo atómico de Ernest Rutherford | 1911 | El átomo tiene un núcleo central pequeño donde se concentra su masa, y los electrones giran alrededor de él en órbitas. | Átomos formados por un núcleo pequeño y cargado positivamente, con electrones girando a su alrededor. |
| Modelo atómico de Bohr | 1913 | En el átomo los electrones se encuentran en órbitas permitidas (niveles de energía), y pueden saltar entre ellas emitiendo o absorbiendo energía. | Átomos formados por un núcleo pequeño y positivo, y los electrones giran a su alrededor, pero solo en trayectorias permitidas. |
| Modelo atómico de Sommerfeld | 1916 | Introdujo órbitas elípticas para los electrones y permitió que los niveles de energía fueran subdivididos. | Átomos formados por un núcleo y electrones girando a su alrededor describiendo órbitas elípticas y circulares. |
| Modelo atómico de Schrödinger | 1926 | El modelo cuántico describe a los electrones como distribuidos en nubes de probabilidades, no en órbitas definidas. | Átomos formados por un núcleo y los electrones formando nubes electrónicas a su alrededor. |
| Modelo atómico actual | actualidad | Los electrones ocupan orbitales dentro de niveles de energía, y el principio de incertidumbre de Heisenberg establece que no se puede conocer con exactitud su posición y velocidad al mismo tiempo. | Átomos formados por un núcleo y electrones descritos probabilísticamente. |
Sigue con:
Referencias
- Halliday, David. (2007) Fundamentals of Physics por Halliday, David. 8ª edición, Wiley. ISBN 0-471-15950-6.
- Feynman, Richard P (2020).Electrodinámica cuántica. Editorial Alianza. ISBN: 9788491818403
- Bransden, B. H. y C. J. Joachain. (1992) Physics of Atoms and Molecules. Longman Group Limited. 0-582-44401-2
- Landau & Lifshitz. (1991) Mecánica. Editorial Reverté, Barcelona. ISBN 84-291-4081-6.











¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)