Te explicamos qué es el modelo atómico de Rutherford, sus características y postulados. Además, entenderás sus limitaciones y el experimento que le dio origen.

¿Qué es el modelo atómico de Rutherford?
El modelo atómico de Rutherford fue uno de los modelos atómicos propuestos para explicar la estructura interna del átomo. En 1911, el químico y físico británico Ernest Rutherford propuso este modelo a partir de los resultados de su experimentación con láminas de oro.
En su modelo atómico, Rutherford propuso que los átomos tienen un núcleo central donde se encuentra el mayor porcentaje de su masa. Además, según esta teoría, este núcleo tiene carga eléctrica positiva y es orbitado por partículas de carga opuesta y menor tamaño (electrones).
Según las consideraciones de Rutherford, el átomo funciona de manera similar a un Sistema Solar, donde los electrones orbitan alrededor de un núcleo atómico más pesado, como hacen los planetas alrededor del Sol.
- Ver también: Modelos atómicos
Postulados del modelo atómico de Rutherford
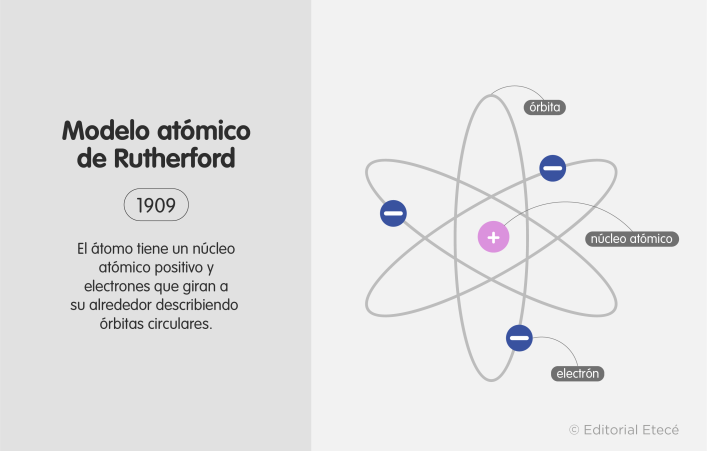
El modelo atómico de Rutherford marcó un paso de avance respecto a las características de los modelos atómicos anteriores, que, si bien habían establecido algunas ideas sobre la composición de la estructura del átomo, no habían propuesto nada sobre la existencia de un núcleo atómico, una de las características claves de este modelo.
Rutherford basó su modelo atómico en ciertas suposiciones que constituyen los siguientes postulados:
- Núcleo central. La mayor parte de la masa del átomo se concentra en el núcleo, que es de mayor tamaño y peso que el resto de las partículas subatómicas.
- Carga del núcleo. El núcleo atómico tiene carga positiva.
- Trayectoria de los electrones. Alrededor del núcleo atómico giran los electrones, que son partículas con carga eléctrica negativa.
- Carga del átomo. La suma de las cargas eléctricas positivas y negativas de un átomo debería dar cero como resultado. Es decir, el átomo debe tener igual cantidad de cargas eléctricas positivas y negativas para que sea eléctricamente neutro.
- Espacio entre las partículas subatómicas. El átomo está compuesto mayormente por espacio vacío.
- Ver además: Átomo
Limitaciones del modelo atómico de Rutherford
El modelo atómico de Rutherford estuvo vigente durante poco tiempo y fue sustituido por el modelo atómico propuesto por el físico danés Niels Bohr en 1913, en el que se resolvían algunas de las limitantes y se incorporaban las propuestas teóricas desarrolladas por Albert Einstein en 1905. Algunas de las limitaciones de este modelo son:
- Interacción de las partículas que forman el núcleo. No se podía explicar cómo era posible que en el núcleo atómico se mantuvieran unidas un conjunto de cargas positivas, pues deberían repelerse por ser todas cargas del mismo signo.
- Estabilidad del átomo. No se podía explicar la estabilidad del átomo, pues al considerar los electrones de carga negativa que giran alrededor del núcleo positivo, en algún momento estos electrones debían perder energía y colapsar contra el núcleo.
Importancia del modelo atómico de Rutherford
El modelo atómico de Rutherford fue el primer modelo en el que se estableció la existencia de un núcleo atómico. Aunque Rutherford no mencionó explícitamente el término “núcleo atómico”, se refirió a él como una región en el centro del átomo donde se concentraba la carga positiva.
Además, el descubrimiento del núcleo atómico dio paso a nuevos planteamientos que llevaron al avance de nuevos estudios y descubrimientos científicos, por ejemplo:
- Descubrimiento de la fuerza nuclear fuerte. Se cuestionó cómo en el núcleo se podían mantener unidas partículas con carga positiva en una región tan pequeña del átomo. Esto llevó al descubrimiento de la fuerza nuclear fuerte, que forma parte de las cuatro interacciones fundamentales.
- Colapso de los electrones contra el núcleo atómico. Se cuestionó cómo es posible que los electrones que giran alrededor del núcleo no colapsen contra él mientras giran a su alrededor, pues los electrones deberían perder toda su energía mientras giran, hasta colapsar contra el núcleo.
- Puede servirte: Modelo atómico de Bohr
Experimento de Rutherford
El método experimental de Rutherford partía del experimento de las láminas de oro. Este experimento consistía en bombardaear con núcleos de helio (partículas alfa, que tienen carga positiva) varias láminas delgadas de oro eran. Se medían, entonces, los ángulos de desviación del haz de partículas al atravesar el oro.
Este comportamiento, que en ocasiones alcanzó desviaciones de hasta 90°, no concordaba con el modelo atómico propuesto por Thompson, imperante en la época.
El modelo de Thompson propone que el átomo es una esfera positiva, con los electrones de carga negativa incrustados en ella. Por esta razón se asemeja el modelo a un budín con pasas: el budín es el átomo y las pasas son los electrones.
El modelo de Rutherford, en cambio, establece que el átomo tiene la carga positiva concentrada en el núcleo y los electrones orbitan alrededor de él. Si el átomo tuviese la estructura planteada por Thomson, las partículas alfa (positivas), al atravesar la lámina de oro, deberían seguir sus trayectorias o desviarse muy poco.
Sin embargo, lo que ocurrió fue que se vieron desviaciones de estas partículas de hasta 90 y 180°, lo que demostró que el átomo efectivamente tiene la carga positiva concentrada en su centro (como proponía Rutherford) y no distribuida en una esfera (como proponía Thompson). Por esta razón, las partículas alfa impactaban contra el centro de carga positiva (núcleo atómico) y experimentaban las desviaciones.
Sigue con:
Referencias
- Bransden, B. H. y C. J. Joachain. (1992) Physics of Atoms and Molecules. Longman Group Limited. 0-582-44401-2
- Landau & Lifshitz. (1991) Mecánica. Editorial Reverté, Barcelona. ISBN 84-291-4081-6.
- Herron, J.D. (1977) Rutherford and the nuclear atom. J. Chem. Educ.

¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)