Te explicamos qué es una batería y cómo funciona este artefacto. Además, los tipos de baterías que existen y qué es una pila.

¿Qué es una batería?
Una batería eléctrica, también llamada pila o acumulador eléctrico, es un artefacto compuesto por celdas electroquímicas capaces de convertir la energía química en su interior en energía eléctrica. Así, las baterías generan corriente continua y, de esta manera, sirven para alimentar distintos circuitos eléctricos, dependiendo de su tamaño y potencia.
Las baterías están plenamente incorporadas a nuestra vida cotidiana desde su invención en el siglo XIX y su comercialización masiva en el XX. El desarrollo de las baterías va de la mano con el avance tecnológico de la electrónica. Controles remotos, relojes, computadores de todo tipo, teléfonos celulares y un enorme grupo de artefactos contemporáneos utilizan pilas como fuente de alimentación eléctrica, por lo que se fabrican con diversas potencias.
Las baterías poseen una capacidad de carga determinada por la naturaleza de su composición y que se mide en amperios-hora (Ah), lo que significa que la pila puede dar un amperio de corriente a lo largo de una hora continua de tiempo. Mientras mayor sea su capacidad de carga, más corriente podrá almacenar en su interior.
Por último, el breve ciclo de vida de la mayoría de las baterías comerciales las ha convertido en un potente contaminante de aguas y suelos, dado que una vez cumplido su ciclo vital no pueden recargarse ni reusarse, y son desechadas. Tras oxidarse su cubierta metálica, las pilas vierten al medio ambiente su contenido químico y alteran su composición y su pH.
Ver además: Conductividad eléctrica
¿Cómo funciona una batería?

El principio fundamental de una batería consiste en las reacciones de oxidación-reducción (redox) de ciertas sustancias químicas, una de las cuales pierde electrones (se oxida) mientras la otra gana electrones (se reduce), pudiendo retornar a su configuración inicial dadas las condiciones necesarias: la aplicación de electricidad (carga) o el cierre del circuito (descarga).
Las baterías contienen celdas químicas que presentan un polo positivo (ánodo) y otro negativo (cátodo), así como electrolitos que permiten el flujo eléctrico hacia el exterior. Dichas celdas convierten la energía química en eléctrica, mediante un proceso reversible o irreversible, según el tipo de batería, que una vez completo, agota su capacidad para recibir energía. En eso se distinguen dos tipos de celdas:
- Primarias. Aquellas que, una vez producida la reacción, no pueden volver a su estado original, agotando así su capacidad de almacenar corriente eléctrica. También se les llaman pilas no recargables.
- Secundarias. Aquellas que pueden recibir una aplicación de energía eléctrica para restaurar su composición química original, y pueden ser empleadas numerosas veces antes de agotarse del todo. También se les llaman pilas recargables.
Tipos de batería

Existen muchos tipos de baterías, atendiendo a los elementos empleados en su fabricación, tales como:
- Baterías alcalinas. Comúnmente desechables. Emplean hidróxido de potasio (KOH) como electrolito. La reacción química que produce energía ocurre entre el zinc (Zn, ánodo) y el dióxido de manganeso (MnO2, cátodo). Son pilas sumamente estables, pero de corta vida.
- Baterías de ácido-plomo. Comunes en vehículos y motocicletas. Son pilas recargables que cuando están cargadas poseen dos electrodos de plomo: un cátodo de dióxido de plomo (PbO2) y un ánodo de plomo esponjoso (Pb). El electrolito empleado es ácido sulfúrico (H2SO4) en solución acuosa. Por otra parte, cuando la batería está descargada el plomo se encuentra en forma de sulfato de plomo (II) (PbSO4) depositado en plomo metálico (Pb). Entonces, durante la carga inicial el PbSO4 se reduce a Pb en las placas negativas, y se forma PbO2 en las positivas. En este proceso el plomo se oxida y se reduce a la vez. Por otro lado, durante la descarga el PbO2 se reduce a PbSO4 y el Pb se oxida para producir también PbSO4. Estos dos procesos se pueden repetir cíclicamente hasta que los cristales de PbSO4 se vuelven demasiado grandes por lo que pierden reactividad química. Este es el caso donde se dice coloquialmente que la batería se ha sulfatado y hay que sustituirla por una nueva.

- Baterías de níquel. De muy bajo coste pero pésimo rendimiento, son algunas de las primeras en manufacturarse en la historia. A su vez, dieron origen a nuevas baterías como:
- Níquel-hierro (Ni-Fe). Consistían en tubos finos enrollados por láminas de acero niquelado. En las placas positivas tenían hidróxido de níquel (III) (Ni(OH)3) y en las negativas hierro (Fe). El electrolito empleado es hidróxido de potasio (KOH). Si bien su duración era muy larga, se dejaron de fabricar por su bajo rendimiento y su alto costo.
- Níquel-cadmio (Ni-Cd). Están compuestas por un ánodo de cadmio (Cd) y un cátodo de hidróxido de níquel (III) (Ni(OH)3), e hidróxido de potasio (KOH) como electrolito. Estos acumuladores son perfectamente recargables, pero presentan baja densidad energética (apenas 50Wh/kg). Además, cada vez se usan menos debido a su elevado efecto memoria (reducción de la capacidad de las baterías cuando realizamos cargas incompletas) y a que el cadmio es muy contaminante.

- Níquel-hidruro (Ni-MH). Emplean oxihidróxido de níquel (NiOOH) para el ánodo y una aleación de hidruro metálico como cátodo. Poseen una mayor capacidad de carga y menor efecto memoria respecto a las baterías de Ni-Cd, además no afectan el medio ambiente ya que no tienen Cd (muy contaminante y peligroso). Fueron las pioneras en usarse para vehículos eléctricos, dado que son perfectamente recargables.
- Baterías de iones de litio (Li-ION). Emplean como electrolito una sal de litio. Son las baterías más empleadas en la electrónica de pequeño tamaño, como celulares y otros artefactos portátiles. Se destacan por su enorme densidad energética, sumado a que son muy livianas, tienen pequeño tamaño y buen rendimiento, pero poseen una vida máxima de tres años. Otra ventaja que tienen es su bajo efecto memoria. Además, al sobrecalentarse pueden explotar, ya que sus elementos son inflamables, por lo que su costo de producción es elevado debido a que hay que incorporarles elementos de seguridad.
- Baterías de polímero de litio (LiPo). Son una variación de las ordinarias baterías de litio, presentan mejor densidad de energía y mejor tasa de descarga, pero presentan el inconveniente de quedar inutilizadas si pierden su carga por debajo del 30%, por lo que es fundamental no dejar que se descarguen completamente. También pueden sobrecalentarse y explotar, por lo que es muy importante nunca dejar pasar demasiado tiempo hasta mirar la batería, o siempre mantenerla en un lugar seguro lejos de sustancias inflamables.
Pila y batería

Los términos pila y batería en este contexto son sinónimos, y provienen de los tiempos iniciales de la manipulación humana de la electricidad. Los primeros acumuladores consistían en agrupaciones de celdas o discos metálicos para aumentar la corriente suministrada inicialmente, y que podían disponerse de dos formas: uno sobre el otro, formando una pila, o uno junto al otro, en forma de batería.
Debe aclararse, no obstante, que en muchos países de habla hispana se emplea únicamente el término batería, y se prefiere acumulador para otros artefactos eléctricos, como los condensadores, etc.
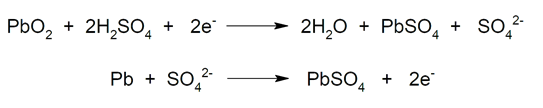
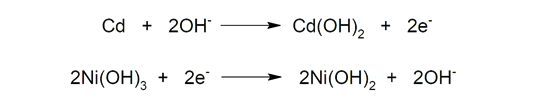
¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)