Te explicamos qué es un compuesto químico, qué tipos existen y la composición química del agua. Además, los elementos químicos.

¿Qué es un compuesto químico?
Un compuesto químico es cualquier sustancia formada por la unión de dos o más tipos de elementos químicos, o sea, por átomos de dos o más tipos diferentes de elementos químicos, unidos entre sí por enlaces químicos de alguna clase.
Un compuesto químico no puede ser separado en los elementos que lo constituyen mediante métodos físicos (destilación, decantación , etc). La única forma de separar un compuesto químico en sus elementos constitutivos es mediante reacciones químicas.
El nivel de complejidad de un compuesto químico puede ser muy sencillo o muy complejo, esto depende de la cantidad de átomos que lo formen y la manera en que se combinen. Existen compuestos formados por unos pocos átomos y compuestos formados por cientos de átomos enlazados y ocupando posiciones muy específicas en el compuesto.
Por ejemplo, son compuestos químicos sustancias binarias como el dióxido de carbono (CO2) o el agua (H2O). También lo son otras más complejas como el ácido sulfúrico (H2SO4) o la glucosa (C6H12O6), o incluso macromoléculas inexpresables en una fórmula química simple, como una molécula de ADN humano.
A pesar de ser aglomeraciones más o menos complejas de elementos, los compuestos químicos presentan un conjunto estable de propiedades físicas y químicas.
Por otro lado, un cambio aparentemente menor en la configuración de sus átomos constitutivos puede producir cambios radicales en dichas propiedades, o bien puede producir sustancias totalmente nuevas a través de una reacción química.
Puede servirte: Producto en química
Tipos de compuestos químicos
Los compuestos químicos pueden clasificarse según dos criterios distintos, que son:
Según el tipo de enlace entre sus átomos
Dependiendo de qué tipo de enlace exista entre los elementos constituyentes de un compuesto químico, se pueden clasificar en:
- Moléculas. Unidas por enlaces covalentes (compartimiento de electrones).
- Iones. Unidos por enlaces electromagnéticos y dotados de carga positiva o negativa.
- Compuestos intermetálicos. Unidos por enlaces metálicos, que suelen darse obviamente entre átomos de tipo metálico.
- Complejos. Que mantienen unidas sus largas estructuras mediante enlaces covalentes coordinados (es un tipo de enlace covalente en el que el par de electrones compartido es aportado por solo uno de los átomos que participan en este enlace).
Según la naturaleza de su composición
Dependiendo del tipo de átomos que los integren, se pueden clasificar en:
- Compuestos orgánicos. Son aquellos que tienen el carbono como elemento base, en torno al cual se estructuran los demás átomos. Son los compuestos fundamentales para la química de la vida. Pueden ser:
- Alifáticos. Son compuestos orgánicos que no son aromáticos. Pueden ser lineales o cíclicos.
- Aromáticos. Son compuestos orgánicos formados por estructuras con enlaces conjugados. Esto significa que se alterna un enlace doble o triple, con un enlace simple a lo largo de toda la estructura. Son muy estables.
- Heterocíclicos. Son compuestos orgánicos cuya estructura es cíclica, pero al menos un átomo del ciclo es un elemento diferente al carbono.
- Organometálicos. Son compuestos orgánicos en los que un metal también forma parte de su estructura.
- Polímeros. Son macromoléculas formadas por monómeros (moléculas más pequeñas).
- Compuestos inorgánicos. Son aquellos cuya base no siempre es el carbono. Son de naturaleza muy diversa y se presentan en todos los estados de agregación. Estos se clasifican en:
- Óxidos básicos. Se forman cuando un metal reacciona con el oxígeno. Por ejemplo: óxido de hierro (II) (FeO)
- Óxidos ácidos. Se forman por enlaces entre el oxígeno y un elemento no metálico. Por ejemplo: óxido de cloro (VII) (Cl2O7)
- Hidrocarburos. Pueden ser metálicos y no metálicos. Los hidruros metálicos se forman por unión de un anión hidruro (H–) de carga eléctrica negativa, con un catión metálico cualquiera (carga positiva). Los hidruros no metálicos se forman por unión de un no metal (que en este caso siempre reacciona con su menor estado de oxidación) y el hidrógeno. Estos últimos generalmente son gaseosos y se nombran anteponiendo el nombre del no metal seguido de la frase -de hidrógeno. Por ejemplo: hidruro de Litio (LiH), hidruro de berilio (BeH2), fluoruro de hidrógeno (HF(g)), cloruro de hidrógeno (HCl(g)).
- Hidrácidos. Son compuestos formados por hidrógeno y un no metal. Al disolverlos en agua dan soluciones ácidas. Por ejemplo: ácido fluorhídrico (HF(ac)), ácido clorhídrico (HCl(ac)).
- Hidróxidos (o bases). Son compuestos formados por la unión de un óxido básico y agua. Se reconocen por el grupo funcional hidroxilo -OH. Por ejemplo: hidróxido de plomo (II) ( Pb(OH)2), hidróxido de litio (LiOH).
- Oxácidos. Son compuestos que también se nombran oxoácidos u oxiácidos (y popularmente “ácidos”). Son ácidos que contienen oxígeno. Se forman cuando reacciona un óxido ácido y agua. Por ejemplo: ácido sulfúrico (H2SO4), ácido hiposulfuroso (H2SO2).
- Sales. Las sales son producto de la unión de sustancias ácidas y básicas. Se clasifican en: neutras, ácidas, básicas y mixtas.
- Sales neutras. Se forman por la reacción entre un ácido y una base o hidróxido, que libera agua en el proceso. Pueden ser binarias y ternarias dependiendo de si el ácido es un hidrácido o un oxácido respectivamente. Por ejemplo: cloruro de sodio (NaCl), tricloruro de hierro (FeCl3), fosfato de sodio (Na3PO4)
- Sales ácidas. Se forman por reemplazo del hidrógeno en un ácido por átomos metálicos. Por ejemplo: hidrogenosulfato (VI) de sodio (NaHSO4).
- Sales básicas. Se forman reemplazando los grupos hidroxilos de una base por los aniones de un ácido. Por ejemplo: dihidroxicloruro de hierro (III) (FeCl(OH)2).
- Sales mixtas. Son producidas al sustituir los hidrógenos de un ácido por átomos metálicos de distintos hidróxidos. Por ejemplo: tetraoxosulfato de sodio y potasio (NaKSO4).
Ejemplos cotidianos de compuestos químicos

Es fácil hallar ejemplos cotidianos de compuestos químicos. Basta con echar un vistazo a la cocina: son compuestos químicos el agua (H2O), el azúcar o sacarosa (C12H22O11), la sal (NaCl), el aceite (glicerol y tres radicales carboxilatos) o el vinagre, que es una dilución de ácido acético (C2H4O2).
Lo mismo, aunque a niveles de complejidad muy superiores, ocurre con la mantequilla, el queso, la leche o el vino.
Elementos químicos y compuestos químicos
Los elementos químicos son los diferentes tipos de átomos que componen la materia, y que se distinguen entre sí según la configuración particular de sus partículas subatómicas (protones, neutrones y electrones).
Los elementos químicos se pueden agrupar de acuerdo a sus propiedades químicas, o sea, a las fuerzas a las que responden con mayor o menor facilidad, al comportamiento que exhiben en determinadas reacciones, o a otros rasgos propios estructurales. Están representados, clasificados y organizados en la Tabla Periódica de los elementos.
Los compuestos químicos son combinaciones de elementos químicos de distinta complejidad. Los elementos químicos son las piezas mínimas de la materia, que no pueden ser descompuestas en piezas menores por métodos físicos (es necesario recurrir a los métodos químicos para esto).
Un ejemplo de compuesto químico es el agua. Este compuesto está formado por hidrógeno y oxígeno. Si se logra descomponer la molécula de agua, el oxígeno y el hidrógeno puro existen en sus formas moleculares en estado gaseoso O2 y H2.
Composición química del agua
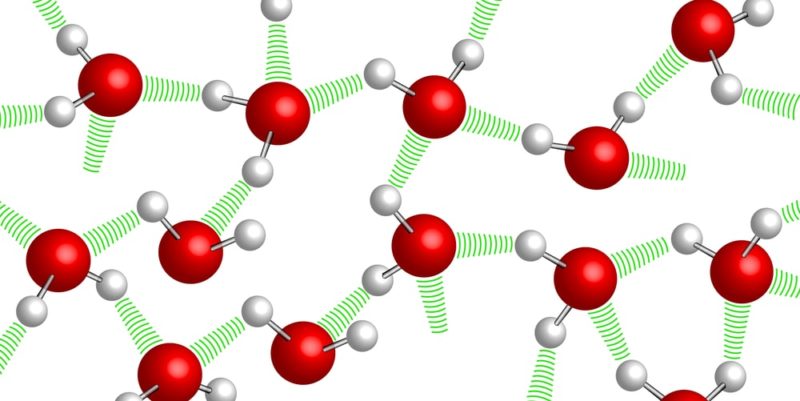
Tal y como lo denota su fórmula química (H2O), a pesar de ser una sustancia simple, el agua es un compuesto químico formado por dos tipos de elementos: hidrógeno (H) y oxígeno (O), en una proporción fija y determinada en cada una de sus moléculas: dos átomos de hidrógeno por cada átomo de oxígeno.
Estos átomos se encuentran unidos por enlaces covalentes, que le confieren a la molécula una gran estabilidad. Además, le otorgan propiedades dipolares que permiten la formación de puentes entre los átomos de hidrógeno de una molécula de agua y las demás (puentes de hidrógeno).
Sigue con:
Referencias
- “¿Qué son los compuestos químicos?” https://www.areaciencias.com/
- “Chemical Compound” https://www.sciencedaily.com/
- “Chemical compound” https://www.britannica.com/




¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)