Te explicamos qué es la nomenclatura química y sus tipos. Además, las nomenclaturas en química orgánica e inorgánica, y la nomenclatura tradicional, STOCK y IUPAC.

¿Qué es la nomenclatura química?
La nomenclatura química es el conjunto de normas y fórmulas que determinan la manera de nombrar y representar a los diversos compuestos químicos conocidos por el ser humano, dependiendo de los elementos que los componen y de la proporción en cada elemento.
La importancia de la nomenclatura química radica en la posibilidad de nombrar, organizar y clasificar los diversos tipos de compuestos químicos, de manera tal que solamente con su término identificativo se pueda tener una idea de qué tipo de elementos los componen y, por lo tanto, qué tipo de reacciones pueden esperarse de estos compuestos.
Hay tres diferentes sistemas de nomenclatura química: el sistema estequiométrico o sistemático, que es el recomendado por la IUPAC; el sistema funcional, también conocido como clásico o tradicional; y el sistema STOCK.
Por otro lado, la nomenclatura química varía dependiendo de si se trata de compuestos orgánicos o inorgánicos.
Ver además: Número de Avogadro
Tipos de sistemas de nomenclatura química
Existen tres sistemas de nomenclatura química:
- Sistema estequiométrico o sistemático (recomendado por la IUPAC). Nombra los compuestos en base al número de átomos de cada elemento que los forman. Por ejemplo: El compuesto Ni2O3 se llama trióxido de diníquel.
- Sistema funcional, clásico o tradicional. Emplea diversos sufijos y prefijos (como -oso, -ico, hipo-, per-) según la valencia atómica de los elementos del compuesto. Este sistema de nomenclatura se encuentra mayormente en desuso. Por ejemplo: El compuesto Ni2O3 se llama óxido niquélico.
- Sistema STOCK. En este sistema el nombre del compuesto incluye en números romanos (y a veces como subíndice) la valencia de los átomos presentes en la molécula del compuesto. Por ejemplo: El compuesto Ni2O3 se llama óxido de níquel (III).
Nomenclatura en química orgánica

Antes de hablar de la nomenclatura de los distintos tipos de compuestos orgánicos es necesario definir el término “localizador”. El localizador es el número que se utiliza para indicar la posición de un átomo en una cadena o ciclo hidrocarbonado. Por ejemplo, en el caso del pentano (C5H12) y el ciclopentano (C5H10), se enumera cada átomo de carbono como se muestra en la siguiente figura:
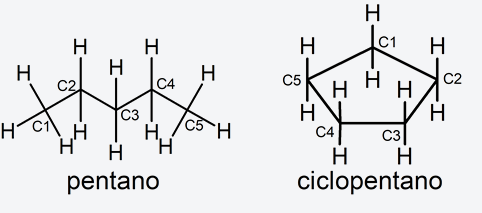
Por otra parte, es conveniente mencionar la tetravalencia del carbono, lo que quiere decir que este elemento tiene 4 valencias, por tanto, puede formar solo 4 enlaces con una amplia combinación de ellos. Eso explica la razón por la cual en cada compuesto orgánico casi nunca veremos, ni pondremos un átomo de carbono con más de 4 enlaces.
En química orgánica existen principalmente dos sistemas de nomenclatura:
Nomenclatura sustitutiva. Se reemplaza un hidrógeno de la estructura hidrocarbonada por el correspondiente grupo funcional. Dependiendo de si el grupo funcional actúa como sustituyente o como función principal, se le nombrará como prefijo o sufijo del nombre del hidrocarburo. Por ejemplo:
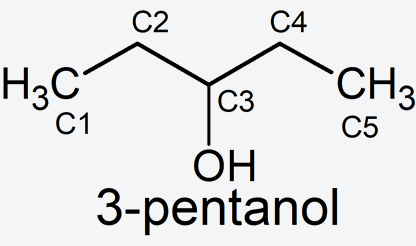
- Función principal. Se sustituye un hidrógeno del carbono 3 del pentano por el grupo -OH (-ol). Se nombra: 3-pentanol.

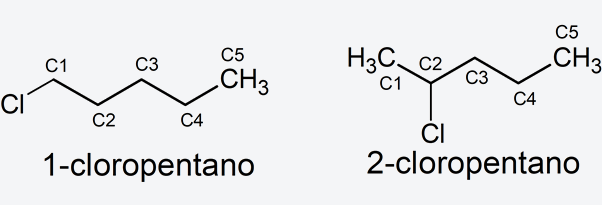
- Sustituyente. Se sustituye un hidrógeno del carbono 1 del pentano por el grupo -Cl (cloro-), se nombra, 1-cloropentano. Si se sustituye un hidrógeno del carbono 2, se nombra, 2-cloropentano.

Aclaración: Los hidrógenos en las estructuras anteriores están implícitos para mayor simplicidad. Cada unión entre dos líneas significa que hay un átomo de carbono con sus hidrógenos correspondientes, siempre respetando la tetravalencia.
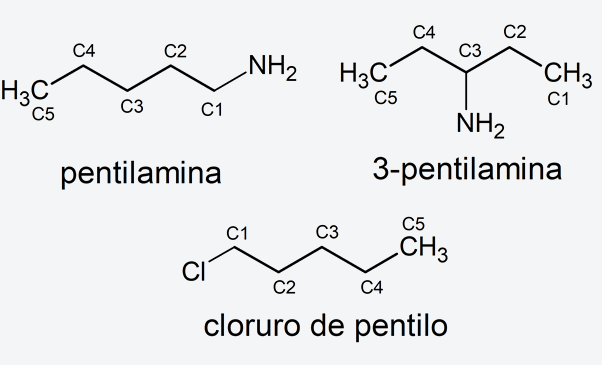
Nomenclatura radical-función. Se pone el nombre del radical correspondiente al hidrocarburo como sufijo o prefijo del nombre del grupo funcional. En caso de ser un grupo funcional del tipo función principal sería, por ejemplo, pentilamina o 2-pentilamina. En caso de ser un grupo funcional tipo sustituyente sería, por ejemplo, cloruro de pentilo (se puede ver que es la misma estructura que el 1-cloropentano pero usando otra nomenclatura para nombrarlo).
| Prefijo | Grupo funcional | Prefijo | Grupo funcional |
|---|---|---|---|
| -F | fluoro- | -NO2 | nitro- |
| -Cl | cloro- | -OR | R-oxi- |
| -Br | bromo- | -NO | nitroso- |
| -I | yodo- | -N3 | azido- |
Tabla 1: Nombres de sustituyentes muy comunes.
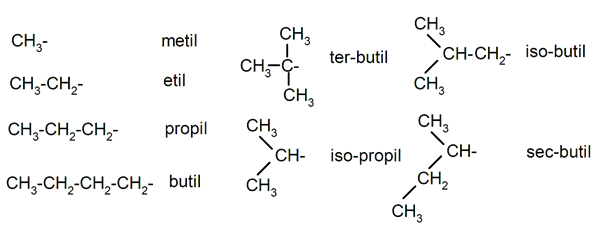
Tabla 2: Nombres de radicales orgánicos muy comunes.
Nomenclatura de hidrocarburos
Los hidrocarburos son compuestos constituidos por átomos de carbono (C ) e hidrógeno (H). Se clasifican en:
Hidrocarburos alifáticos
Son compuestos no aromáticos. Si su estructura se cierra y forma un ciclo, se les llama compuestos alicíclicos. Por ejemplo:
Alcanos. Son compuestos de naturaleza acíclica (que no forman ciclos) y saturada (todos sus átomos de carbono están enlazados entre sí con enlaces covalentes simples). Responden a la fórmula general CnH2n+2, donde n representa el número de átomos de carbono. En todos los casos se emplea el sufijo -ano para nombrarlos. Pueden ser:
- Alcanos lineales. Poseen una cadena lineal. Para nombrarlos se combinará el sufijo -ano con el prefijo que denota el número de átomos de carbono presentes. Por ejemplo, el hexano tiene 6 átomos de carbono (hex-) (C6H14). En la Tabla 3 se muestran algunos ejemplos.

| Nombre | Cantidad de carbonos | Nombre | Cantidad de carbonos |
|---|---|---|---|
| metano | 1 | heptano | 7 |
| etano | 2 | octano | 8 |
| propano | 3 | nonano | 9 |
| butano | 4 | decano | 10 |
| pentano | 5 | undecano | 11 |
| hexano | 6 | dodecano | 12 |
Tabla 3: Nombres de alcanos según la cantidad de átomos de carbono que contiene su estructura.
- Alcanos ramificados. De no ser lineales sino ramificados, debe buscarse la cadena hidrocarbonada más larga y que posea más ramificaciones (la cadena principal), se cuentan sus átomos de carbono desde el extremo más próximo a la ramificación y se nombran las ramificaciones indicando su posición en la cadena principal (como vimos con el localizador), reemplazando el sufijo -ano por -il (ver Tabla 2) y añadiendo los prefijos numéricos correspondientes en caso de haber dos o más cadenas iguales. La cadena principal se elige de manera que tenga la menor combinación de localizadores posibles. Finalmente se nombra la cadena principal normalmente. Por ejemplo, el 5-etil-2-metilheptano tiene una cadena principal de heptano (hep-, 7 átomos de carbono) con un radical metil (CH3-) en el segundo átomo de carbono y uno etil (C2H5-) en el quinto. Esta es la menor combinación posible de posiciones de las ramas para este compuesto.

- Radicales de alcanos (producidos al perder un átomo de hidrógeno unido a uno de sus carbonos). Se nombran sustituyendo el sufijo -ano por -ilo e indicándolo con un guión en el enlace químico Por ejemplo, del metano (CH4) se obtiene el radical metilo (CH3-). (Ver Tabla 2). Conviene aclarar que, para la nomenclatura también se puede usar la terminación -il para los radicales cuando actúan como sustituyentes. Por ejemplo:

- Cicloalcanos. Son compuestos alicíclicos que responden a la fórmula general CnH2n. Se nombran como los alcanos lineales pero añadiendo el prefijo ciclo- al nombre, por ejemplo, ciclobutano, ciclopropano, 3-isopropil-1-metil-ciclopentano. En estos casos, también se debe elegir la menor combinación posible de los números de los átomos que tienen sustituyentes. Por ejemplo:

Alquenos y alquinos. Son hidrocarburos insaturados, pues presentan un doble (alquenos) o triple (alquinos) enlace carbono-carbono. Responden, respectivamente, a las fórmulas generales CnH2n y CnH2n-2. Se nombran de manera similar a los alcanos, pero se les aplican diversas reglas en base a la ubicación de sus enlaces múltiples:
- Cuando hay un doble enlace carbono-carbono, se usa el sufijo -eno (en lugar de -ano como en los alcanos) y se añaden los respectivos prefijos de número si el compuesto tiene más de un doble enlace, por ejemplo, -dieno, -trieno, -tetraeno.
- Cuando hay un triple enlace carbono-carbono, se usa el sufijo -ino y se le añaden los respectivos prefijos de número si el compuesto tiene más de un triple enlace, por ejemplo, -diino, -triino, -tetraino.
- Cuando hay enlaces dobles y triples carbono-carbono, se usa el sufijo -enino y se le añaden los respectivos prefijos de número si son varios de estos enlaces múltiples, por ejemplo, -dienino, -trienino, -tetraenino.
- Se indica la ubicación del enlace múltiple con el número del primer carbono de dicho enlace.
- Si hay ramificaciones se elige como cadena principal la cadena más larga con el mayor número de enlaces dobles o triples. La cadena se elige buscando que el localizador del enlace doble o triple sea lo más pequeño posible.
- Los radicales orgánicos que provienen de alquenos se nombran sustituyendo el sufijo -eno por -enilo (si actúa como sustituyente, -enil) y los radicales provenientes de alquinos se sustituye -ino por -inilo (si actúa como sustituyente, -inil).
| Compuesto | Sustituyente | Compuesto | Sustituyente |
|---|---|---|---|
| eteno | etenil | etino | etinil |
| propeno | propenil | propino | propinil |
| buteno | butenil | butino | butinil |
| penteno | pentenil | pentino | pentinil |
| hexeno | hexenil | hexino | hexinil |
| hepteno | heptenil | heptino | heptinil |
| octeno | octenil | octino | octinil |
Tabla 4: Nombres de radicales sustituyentes de alquenos y alquinos.
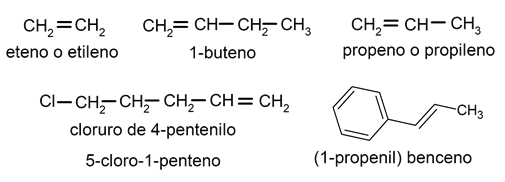

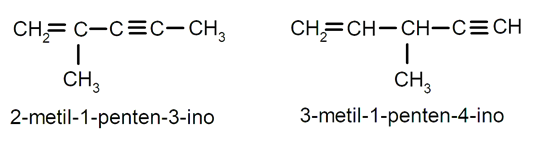
Hidrocarburos aromáticos
Son conocidos como arenos. Son compuestos cíclicos conjugados (que alternan un enlace simple y un enlace múltiple en su estructura). Tienen anillos de estructuras planas y muy estables debido a la conjugación. Muchos incluyen el benceno (C6H6) y sus derivados, aunque existen otras numerosas variedades de compuestos aromáticos. Se pueden clasificar en:
- Monocíclicos. Se nombran a partir de derivaciones del nombre del benceno (o algún otro compuesto aromático), enumerando sus sustituyentes con prefijos numeradores (localizadores). Si el anillo aromático tiene varios sustituyentes se nombran en orden alfabético, siempre buscando la menor combinación posible de los localizadores. Si algún sustituyente involucra un anillo, este se pone en la posición uno en el anillo aromático, y se continúa nombrando según el orden alfabético del resto de los sustituyentes. Por otra parte, el radical del anillo benceno se llama fenilo (si actúa como sustituyente, -fenil). Por ejemplo:

Otra forma de definir la posición de los sustituyentes en los hidrocarburos aromáticos es utilizando la nomenclatura orto, meta y para. Esta consiste en ubicar la posición de otros sustituyentes en base a la posición de un sustituyente inicial, por ejemplo:
- Policíclicos. En su mayoría se nombran mediante su nombre genérico, dado que son compuestos muy específicos. Pero también se puede usar para ellos el sufijo -eno o -enilo. Estos policiclos pueden formarse por varios anillos aromáticos condensados, o conectados por enlaces C-C. En estos compuestos los localizadores se suelen poner con números para la estructura principal (la que más ciclos tenga) y con números con “primas” para la estructura secundaria. Por ejemplo:

Alcoholes
Los alcoholes son compuestos orgánicos que contienen un grupo hidroxilo (-OH). Su estructura se forma sustituyendo un H por el grupo -OH en un hidrocarburo, por tanto, se definen por la fórmula general R-OH, donde R es una cadena hidrocarbonada cualquiera. Se nombran empleando el sufijo -ol en lugar de la terminación -o del correspondiente hidrocarburo. Si el grupo -OH actúa como sustituyente, entonces se nombra hidroxi-. Si un compuesto tiene varios grupos hidroxilos, se denomina polialcohol o poliol, y se nombra mediante prefijos numeradores.
Fenoles
Los fenoles son similares a los alcoholes, pero tienen el grupo hidroxilo unido a un anillo aromático de benceno, en lugar de a un hidrocarburo lineal. Responden a la fórmula Ar-OH. Para nombrarlos también se emplea el sufijo -ol unido al del hidrocarburo aromático.
Algunos ejemplos de alcoholes y fenoles son:
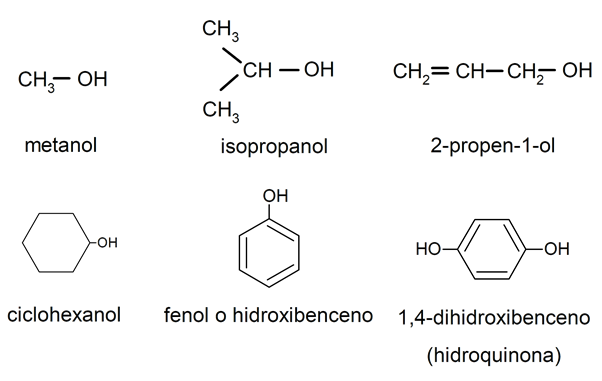
Éteres
Los éteres se rigen por la fórmula general R-O-R’, donde los radicales de los extremos (R- y R’-) pueden ser grupos idénticos o diferentes, del grupo alquilo o arilo. Los éteres se nombran con el término de cada grupo alquilo o arilo en orden alfabético, seguidos de la palabra “éter”. Por ejemplo: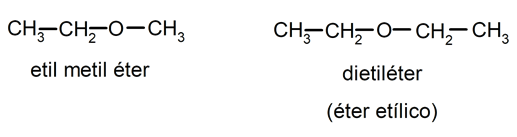
Aminas
Son compuestos orgánicos derivados del amoníaco por sustitución de uno o algunos de sus hidrógenos por grupos radicales alquilos o arilos, obteniendo aminas alifáticas y aminas aromáticas respectivamente. En ambos casos se nombran usando el sufijo -amina o se conserva el nombre general. Por ejemplo:
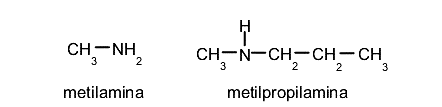
Ácidos carboxílicos
Son compuestos orgánicos que tienen un grupo carboxilo (-COOH) como parte de su estructura. Este grupo funcional está compuesto por un grupo hidroxilo (-OH) y un grupo carbonilo (-C=O). Para nombrarlos se considera como cadena principal la cadena con mayor número de carbonos que contiene el grupo carboxilo. Entonces se emplea como terminación -ico u -oico para nombrarlos. Por ejemplo:
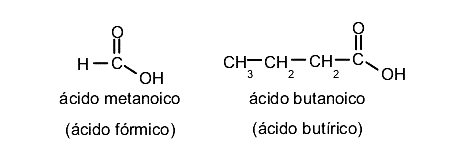
Aldehídos y cetonas
Son compuestos orgánicos que poseen un grupo funcional carbonilo. Si el carbonilo se halla en un extremo de la cadena hidrocarbonada hablaremos de un aldehído, y estará a su vez unido a un hidrógeno y a un grupo alquilo o arilo. Hablaremos de cetonas cuando el carbonilo esté dentro de la cadena hidrocarbonada y unido mediante el átomo de carbono a grupos alquilo o arilo por ambos lados. Para nombrar a los aldehídos se emplea el sufijo -al al final del nombre del compuesto siguiendo las mismas reglas de numeración según la cantidad de átomos. También se pueden nombrar usando el nombre general del ácido carboxílico del que provienen, y cambiando el sufijo -ico por -aldehído. Por ejemplo:
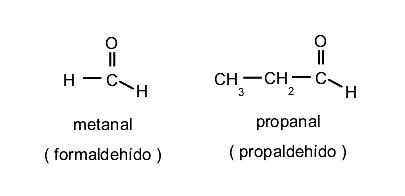
Para nombrar a las cetonas se emplea el sufijo -ona al final del nombre del compuesto siguiendo las mismas reglas de numeración según la cantidad de átomos. También se pueden nombrar los dos radicales unidos al grupo carbonilo seguidos de la palabra cetona. Por ejemplo:
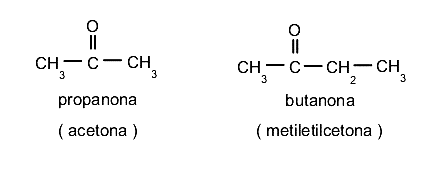
Ésteres
No se deben confundir con los éteres, pues se trata de ácidos cuyo hidrógeno es sustituido por un radical alquilo o arilo. Se nombran cambiando el sufijo -ico del ácido por -ato, seguido del nombre del radical que sustituye al hidrógeno, sin la palabra “ácido”. Por ejemplo: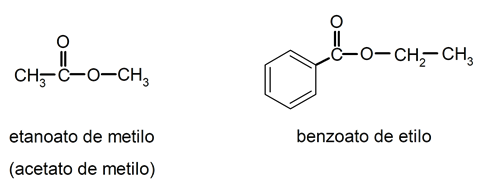
Amidas
No deben confundirse con las aminas. Son compuestos orgánicos que se producen al sustituir el grupo -OH de un ácido de referencia, por el grupo -NH2. Se nombran sustituyendo la terminación -ico del ácido referente por -amida. Por ejemplo:
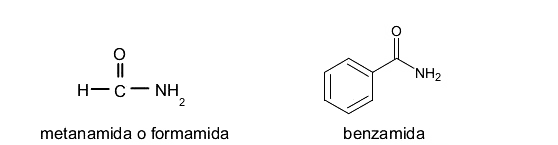
Haluros de ácido
Son compuestos orgánicos derivados de un ácido carboxílico en el que se sustituye el grupo -OH por un átomo de un elemento halógeno. Se nombran sustituyendo el sufijo -ico por -ilo y la palabra “ácido” por el nombre del haluro. Por ejemplo:
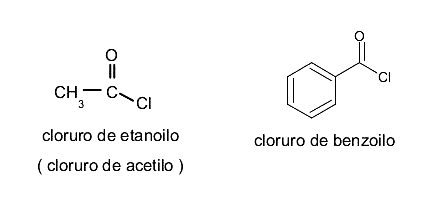
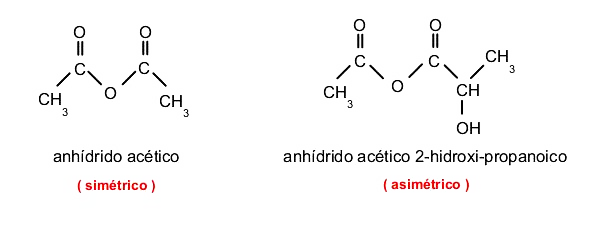
Anhídridos de ácido
Son compuestos orgánicos derivados de los ácidos carboxílicos. Pueden ser simétricos o asimétricos. Si son simétricos se nombran sustituyendo la palabra ácido por “anhídrido”. Por ejemplo: anhídrido acético (del ácido acético). Si no lo son, se combinan ambos ácidos y se anteceden de la palabra “anhídrido”. Por ejemplo:
Nitrilos
Son compuestos orgánicos que tienen el grupo funcional -CN. En este caso se reemplaza la terminación -ico del ácido referente por -nitrilo. Por ejemplo:
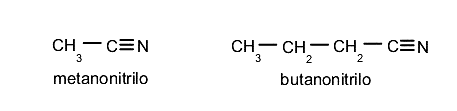
Nomenclatura en química inorgánica

- Óxidos. Son compuestos que se forman con oxígeno y algún otro elemento metálico o no metálico. Se nombran usando prefijos de acuerdo a la cantidad de átomos que tenga cada molécula de óxido. Por ejemplo: trióxido de digalio (Ga2O3), monóxido de carbono (CO). Cuando el elemento oxidado es metálico, se llaman óxidos básicos; cuando es no metálico, se llaman anhídridos u óxidos ácidos. Por lo general el oxígeno en los óxidos tiene estado de oxidación -2.
- Peróxidos. Son compuestos formados por la combinación del grupo peroxo (-O-O-) O2-2 y otro elemento químico. Por lo general, el oxígeno tiene estado de oxidación -1 en el grupo peroxo. Se nombran igual que los óxidos pero con la palabra “peróxido”. Por ejemplo: peróxido de calcio (CaO2), peróxido de dihidrógeno (H2O2).
- Superóxidos. También son conocidos como hiperóxidos. El oxígeno tiene estado de oxidación -½ en estos compuestos. Se nombran regularmente como los óxidos, pero empleando la palabra “hiperóxido” o “superóxido”. Por ejemplo: superóxido o hiperóxido de potasio (KO2).
- Hidruros. Son compuestos formados por hidrógeno y otro elemento. Cuando el otro elemento es metálico, se denominan hidruros metálicos y cuando no es metálico se llaman hidruros no metálicos. Su nomenclatura depende de la naturaleza metálica o no metálica del otro elemento, aunque en algunos casos se usan los nombres comunes, como en el amoníaco (o trihidruro de nitrógeno).
- Hidruros metálicos. Para nombrarlos se utiliza el prefijo numérico según la cantidad de átomos de hidrógeno seguido del término “hidruro”. Por ejemplo: monohidruro de potasio (KH), tetrahidruro de plomo (PbH4).
- Hidruros no metálicos. Se añade la terminación -uro al elemento no metálico y después se añade la frase “de hidrógeno”. Por lo general, se encuentran en estado gaseoso. Por ejemplo: fluoruro de hidrógeno (HF(g)), seleniuro de dihidrógeno (H2Se(g)).
- Oxácidos. Son compuestos que también se nombran oxoácidos u oxiácidos (y popularmente “ácidos”). Son ácidos que contienen oxígeno. Su nomenclatura exige usar el prefijo correspondiente al número de átomos de oxígeno, seguido de la palabra “oxo” unida al nombre del no metal terminado en “-ato”. Al final se añade la frase “de hidrógeno”. Por ejemplo: tetraoxosulfato de hidrógeno o ácido sulfúrico (H2SO4), dioxosulfato de hidrógeno o ácido hiposulfuroso (H2SO2).
- Hidrácidos. Son compuestos formados por hidrógeno y un no metal. Al disolverlos en agua dan soluciones ácidas. Se nombran usando el prefijo “ácido” seguido del nombre del no metal, pero con la terminación “hídrico”. Por ejemplo: ácido fluorhídrico (HF(ac)), ácido clorhídrico (HCl(ac)), ácido sulfhídrico (H2S(ac)), ácido selehídrico (H2Se(ac)) . Siempre que se represente la fórmula de un hidrácido, se debe aclarar que está en disolución acuosa (ac) (de lo contrario, se puede confundir con un hidruro no metálico).
- Hidróxidos o bases. Son compuestos formados por la unión de un óxido básico y agua. Se reconocen por el grupo funcional -OH. Se nombran genéricamente como hidróxido, unido a los prefijos respectivos dependiendo de la cantidad de grupos hidroxilo presentes. Por ejemplo: dihidróxido de plomo o hidróxido de plomo (II) ( Pb(OH)2 ), hidróxido de litio (LiOH).
- Sales. Las sales son producto de la unión de sustancias ácidas y básicas. Se nombran de acuerdo a su clasificación: neutras, ácidas, básicas y mixtas.
- Sales neutras. Se forman por la reacción entre un ácido y una base o hidróxido, liberando agua en el proceso. Pueden ser binarias y ternarias dependiendo de si el ácido es un hidrácido o un oxácido.
- Si el ácido es un hidrácido, se llaman sales haloideas. Se nombran usando el sufijo -uro en el elemento no metálico, y el prefijo correspondiente a la cantidad de este elemento. Por ejemplo: cloruro de sodio (NaCl), tricloruro de hierro (FeCl3).
- Si el ácido es un oxácido, también se llaman oxisales o sales ternarias. Se nombran usando el prefijo numérico según la cantidad de grupos “oxo” (cantidad de oxígenos O2-), y el sufijo -ato en el no metal, seguido del estado de oxidación del no metal escrito en números romanos y entre paréntesis. También se pueden nombrar usando el nombre del anión seguido del nombre del metal. Por ejemplo: tetraoxosulfato (VI) de calcio (Ca2+, S6+, O2- ) o sulfato de calcio (Ca2+, (SO4)2-) (CaSO4), tetraoxofosfato (V) de sodio (Na1+, P5+, O2-) o fosfato de sodio (Na1+, (PO4)3-) (Na3PO4).
- Sales ácidas. Se forman por reemplazo del hidrógeno en un ácido por átomos metálicos. Su nomenclatura es igual a la de las sales neutras ternarias, pero añadiendo la palabra “hidrógeno”. Por ejemplo: hidrogenosulfato (VI) de sodio (NaHSO4), se cambia un hidrógeno del ácido sulfúrico (H2SO4) por un átomo de sodio, hidrogenocarbonato de potasio (KHCO3), se cambia un hidrógeno del ácido carbónico (H2CO3) por un átomo de potasio.
- Sales básicas. Se forman reemplazando los grupos hidroxilos de una base por los aniones de un ácido. Su nomenclatura depende de o un oxácido.
- Si el ácido es un hidrácido, se emplea el nombre del no metal con el sufijo -uro y se le antepone el prefijo numeral de la cantidad de grupos -OH, seguido del término “hidroxi”. Al final se pone el estado de oxidación del metal si es necesario. Por ejemplo: FeCl(OH)2 sería dihidroxicloruro de hierro (III).
- Si el ácido es un oxácido, se usa el término “hidroxi” con su prefijo numeral correspondiente. Después se añade el sufijo correspondiente a la cantidad de grupos “oxo” y se pone la terminación -ato al no metal, seguido de su estado de oxidación escrito en números romanos y entre paréntesis. Por último, se pone el nombre del metal seguido de su estado de oxidación escrito en números romanos y entre paréntesis. Por ejemplo: Ni2(OH)4SO3 sería tetrahidroxitrioxosulfato (IV) de níquel (III).
- Sales mixtas. Son producidas al sustituir los hidrógenos de un ácido por átomos metálicos de distintos hidróxidos. Su nomenclatura es idéntica a la de las sales ácidas, pero incluyendo ambos elementos. Por ejemplo: tetraoxosulfato de sodio y potasio (NaKSO4).
- Sales neutras. Se forman por la reacción entre un ácido y una base o hidróxido, liberando agua en el proceso. Pueden ser binarias y ternarias dependiendo de si el ácido es un hidrácido o un oxácido.
Nomenclatura IUPAC
La IUPAC (siglas de International Union of Pure and Applied Chemistry, o sea, Unión Internacional de Química Pura y Aplicada) es la organización internacional dedicada a establecer las reglas universales de la nomenclatura química.
Su sistema, propuesto como un sistema simple y unificador, se conoce como nomenclatura IUPAC y difiere de la nomenclatura tradicional en que es más específico a la hora de nombrar los compuestos, pues no solo los nombra sino que también aclara la cantidad de cada elemento químico en el compuesto.
Sigue con:
Referencias
- “Nomenclatura y fórmulas químicas” (video) en Tu Profe Virtual. https://www.youtube.com/
- “Nomenclatura química” https://www.profesorenlinea.cl/
- “Nomenclatura orgánica: alcanos, alquenos y alquinos” (video) en Quimiayudas. https://www.youtube.com/
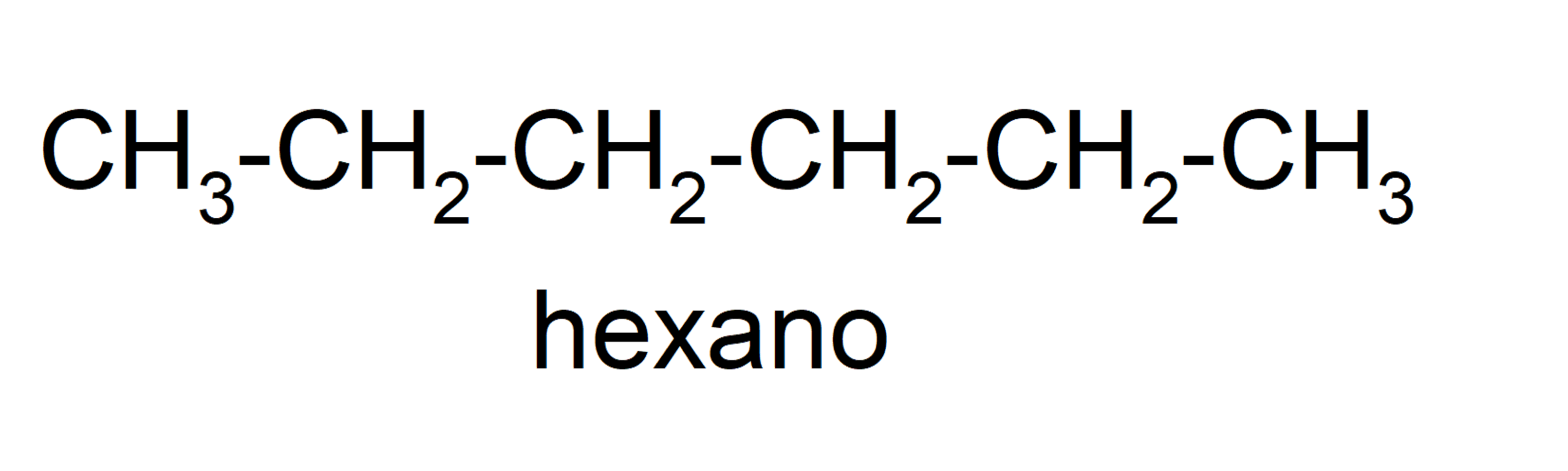
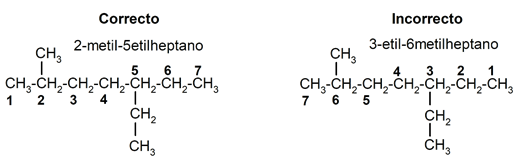
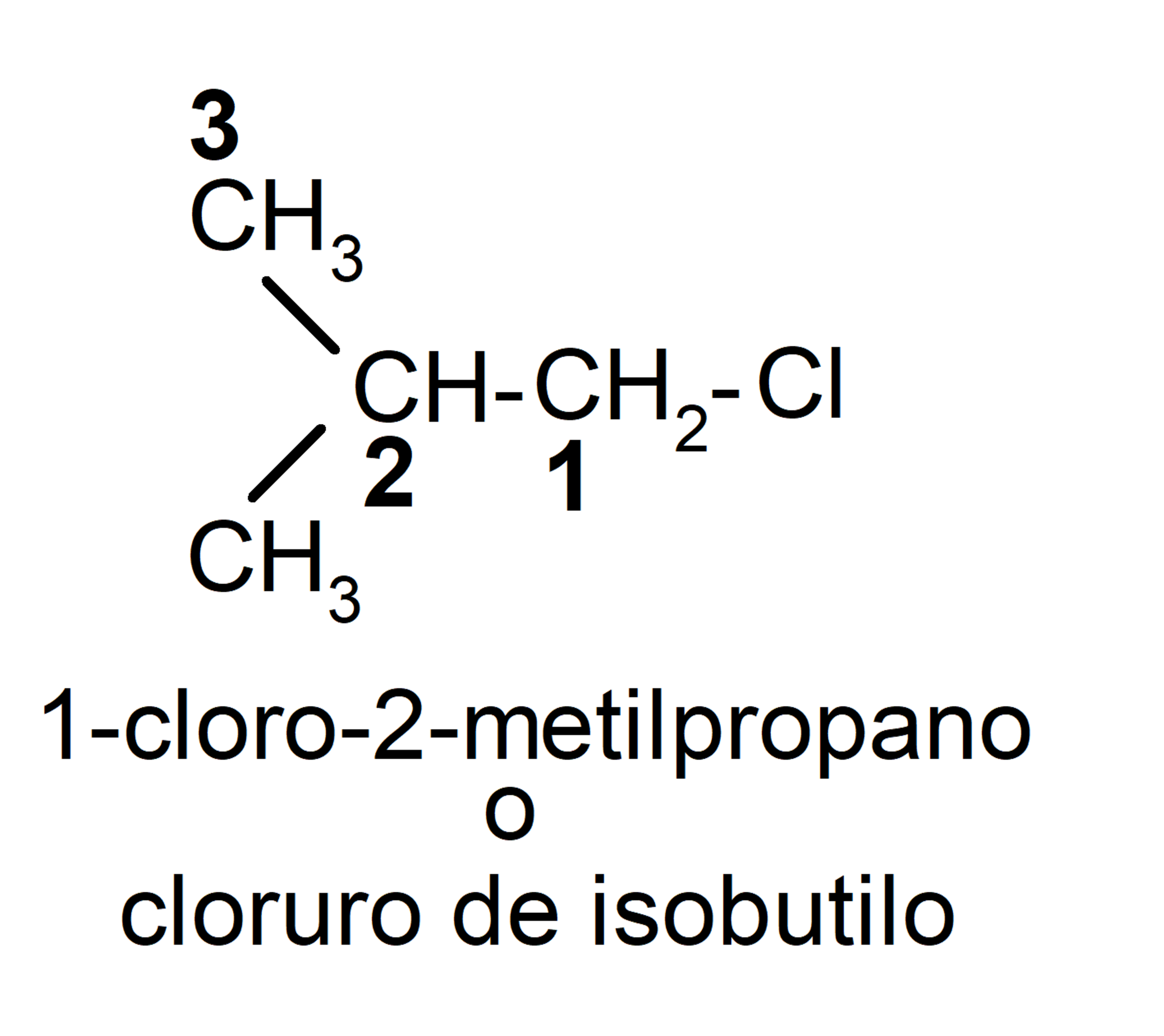

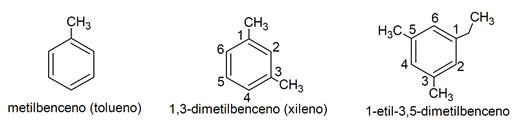

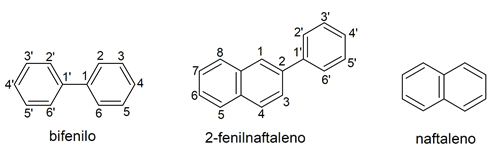



¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)