Te explicamos qué son los alcoholes, su clasificación, nomenclatura y propiedades. Además, ejemplos e importancia en la industria.
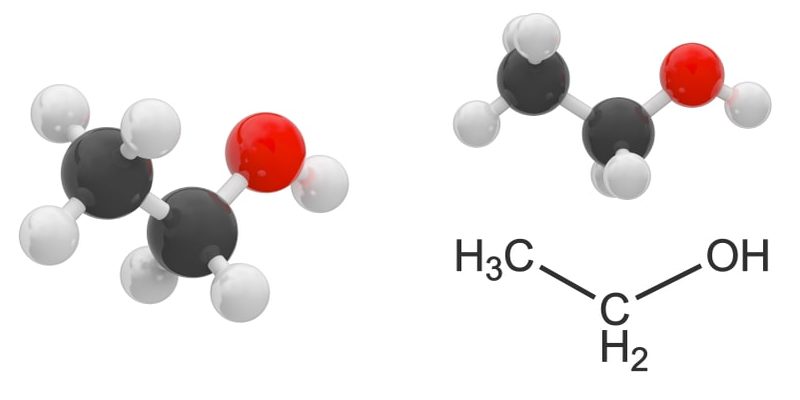
¿Qué son los alcoholes?
Los alcoholes son ciertos compuestos químicos orgánicos, que presentan en su estructura uno o más grupos químicos hidroxilo (-OH) enlazados covalentemente a un átomo de carbono saturado (o sea, con enlaces simples únicamente a los átomos adyacentes), formando un grupo carbinol (-C-OH).
Los alcoholes son compuestos orgánicos muy comunes en la naturaleza, que juegan roles importantes en los organismos vivientes, especialmente en la síntesis orgánica.
Su nombre proviene del árabe al-kukhūl, que literalmente se traduce como “espíritu” o “líquido destilado”. Esto se debe a que los antiguos alquimistas musulmanes llamaban “espíritu” a los alcoholes y, además, perfeccionaron los métodos de destilación en el siglo IX. Estudios posteriores permitieron conocer la naturaleza química de estos compuestos, especialmente los aportes de Lavoisier respecto a la fermentación de la levadura de cerveza.
Los alcoholes pueden ser tóxicos e incluso letales para el organismo humano si son ingeridos en dosis altas. Además, al ser consumidos por el ser humano, pueden actuar como depresores del sistema nervioso central, causar el estado de embriaguez y provocar una conducta más desinhibida de lo normal.
Por otra parte, los alcoholes tienen propiedades antibacterianas y antisépticas que permiten su uso en la industria química y en la medicina.
Puede servirte: Materia orgánica
Tipos de alcoholes
Los alcoholes pueden clasificarse de acuerdo al número de grupos hidroxilo que presenten en su estructura:
- Monoalcoholes o alcoholes. Estos contienen un solo grupo hidroxilo. Por ejemplo:
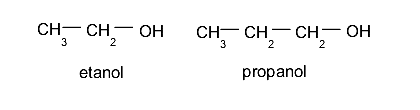
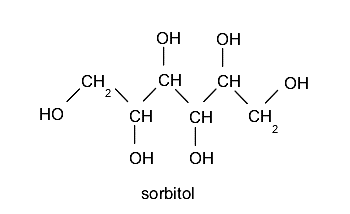
- Polialcoholes o polioles. Contienen más de un grupo hidroxilo. Por ejemplo:
Otra forma de clasificar los alcoholes es según la posición del carbono al cual está enlazado el grupo hidroxilo, teniendo en cuenta también a cuántos átomos de carbono está enlazado además este carbono:
- Alcoholes primarios. El grupo hidroxilo (-OH) se ubica en un carbono enlazado a su vez a otro único átomo de carbono. Por ejemplo:
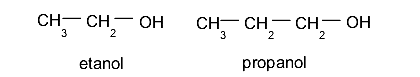
- Alcoholes secundarios. El grupo hidroxilo (-OH) se ubica en un carbono enlazado a su vez a otros dos átomos de carbono distintos. Por ejemplo:
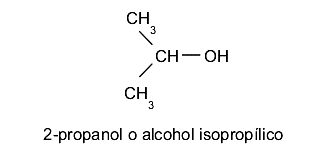
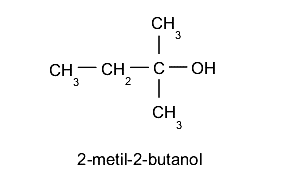
- Alcoholes terciarios. El grupo hidroxilo (-OH) se ubica en un carbono enlazado a su vez a otros tres átomos de carbono distintos. Por ejemplo:
Nomenclatura de los alcoholes
Al igual que otros compuestos orgánicos, los alcoholes tienen distintas formas de nombrarse, que explicaremos a continuación:
- Método tradicional (no sistemático). Se presta atención, ante todo, a la cadena de carbonos a la cual se adhiere el hidroxilo (generalmente un alcano), para rescatar el término con el que se lo nombra, anteponer la palabra “alcohol” y luego añadir el sufijo -ílico en lugar de -ano. Por ejemplo:
- Si se trata de una cadena de metano, se llamará alcohol metílico.
- Si se trata de una cadena de etano, se llamará alcohol etílico.
- Si se trata de una cadena de propano, se llamará alcohol propílico.
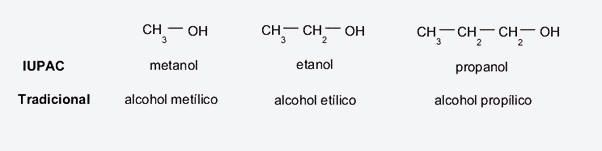
- Método IUPAC. Al igual que el método anterior, se prestará atención al hidrocarburo precursor, para rescatar su nombre y simplemente añadir la terminación -ol en lugar de -ano. Por ejemplo:
- Si se trata de una cadena de metano, se llamará metanol.
- Si se trata de una cadena de etano, se llamará etanol.
- Si se trata de una cadena de propano, se llamará propanol.
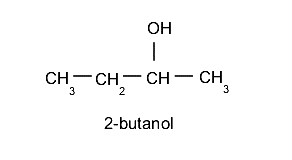
Eventualmente, hará falta indicar de algún modo la ubicación del grupo hidroxilo en la cadena, para lo cual se emplea un número al inicio del nombre. Es importante tener en cuenta que siempre se elige la cadena hidrocarbonada más larga como cadena principal y se debe seleccionar la posición del grupo hidroxilo utilizando la menor numeración posible. Por ejemplo: 2-butanol.
Más en: Nomenclatura química
Propiedades físicas de los alcoholes
Los alcoholes son generalmente líquidos incoloros que presentan un olor característico, aunque también, con menos abundancia, pueden existir en estado sólido. Son solubles en agua ya que el grupo hidroxilo (-OH) tiene cierta similitud con la molécula de agua (H2O), lo que les permite formar puentes de hidrógeno. En este sentido, los alcoholes más solubles en agua son los que menor masa molecular tienen, es decir, los que tienen estructuras más pequeñas y más simples. A medida que aumenta la cantidad de átomos de carbono y la complejidad de la cadena carbonada, menos solubles son en agua los alcoholes.
La densidad de los alcoholes es mayor conforme al aumento del número de átomos de carbono y las ramificaciones de su cadena hidrocarbonada. Por otra parte, la formación de puentes de hidrógeno no solo influye en la solubilidad, sino también en sus puntos de fusión y ebullición. Mientras más grande sea la cadena hidrocarbonada, más grupos hidroxilos tenga y más ramificaciones tenga, mayor serán los valores de estas dos propiedades.
Propiedades químicas de los alcoholes
Los alcoholes presentan un carácter dipolar, semejante al del agua, debido a su grupo hidroxilo. Esto hace de ellos sustancias polares (con un polo positivo y uno negativo).
Debido a esto, los alcoholes pueden comportarse como ácidos o como bases dependiendo de con qué reactivo reaccionen. Por ejemplo, si se hace reaccionar un alcohol con una base fuerte, el grupo hidroxilo se desprotona y el oxígeno retiene su carga negativa, actuando como un ácido.
Por el contrario, si se enfrenta un alcohol a un ácido muy fuerte, los pares electrónicos del oxígeno hacen que el grupo hidroxilo se protone, adquiere carga positiva y se comporta como una base débil.
Por otro lado, los alcoholes pueden participar en las siguientes reacciones químicas:
- Halogenación. Los alcoholes reaccionan con los halogenuros de hidrógeno para dar halogenuros de alquilo y agua. Los alcoholes terciarios reaccionan con mayor facilidad que los primarios y secundarios. Algunos ejemplos de estas reacciones son:

- Oxidación. Los alcoholes se oxidan al reaccionar con ciertos compuestos oxidantes, formando diferentes productos dependiendo del tipo de alcohol que es oxidado (primario, secundario o terciario). Por ejemplo:
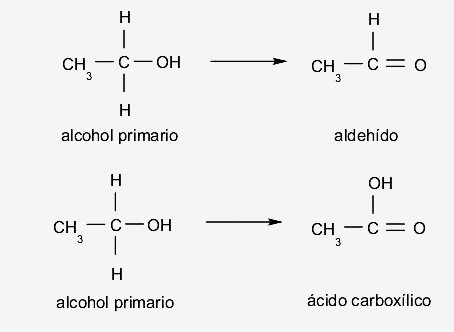
- Alcoholes primarios. Se dan si, cuando se oxidan, pierden un átomo de hidrógeno que está unido al carbono, que a su vez está enlazado al grupo hidroxilo, forman aldehídos. Por otro lado, si pierden los dos átomos de hidrógeno de este carbono, forman ácidos carboxílicos.

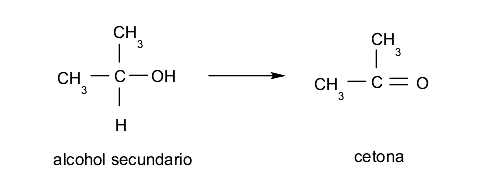
- Alcoholes secundarios. Al oxidarse, pierden el único átomo de hidrógeno enlazado al carbono que tiene el grupo hidroxilo y forman cetonas.

- Alcoholes terciarios. Son resistentes a la oxidación, es decir, no se oxidan, excepto que se les impongan condiciones muy específicas.
- Alcoholes primarios. Se dan si, cuando se oxidan, pierden un átomo de hidrógeno que está unido al carbono, que a su vez está enlazado al grupo hidroxilo, forman aldehídos. Por otro lado, si pierden los dos átomos de hidrógeno de este carbono, forman ácidos carboxílicos.
- Deshidrogenación. Los alcoholes (solo primarios y secundarios) al ser sometidos a altas temperaturas y en presencia de ciertos catalizadores, pierden hidrógenos para formar aldehídos y cetonas.

- Deshidratación. Consiste en añadir un ácido mineral a un alcohol para extraer el grupo hidroxilo y obtener el alqueno correspondiente mediante procesos de eliminación.

Importancia de los alcoholes

Los alcoholes son sustancias de mucho valor químico. Como materia prima, se utilizan en la obtención de otros compuestos orgánicos, en laboratorios. También como componente de productos industriales de uso cotidiano, como desinfectantes, limpiadores, solventes, base de perfumes.
También se utilizan en la fabricación de combustibles, especialmente en la industria de los biocombustibles, alternativa a los de origen fósil. Es frecuente verlos en hospitales, botiquines de primeros auxilios o similares.
Por otro lado, ciertos alcoholes son de consumo humano (especialmente el etanol), parte de numerosas bebidas espirituosas en distinto grado de refinación e intensidad.
Ejemplos de alcoholes
Algunos ejemplos de alcoholes muy utilizados cotidianamente son:
- metanol o alcohol metílico (CH3OH)
- etanol o alcohol etílico (C2H5OH)
- 1-propanol, propanol o alcohol propílico (C3H7OH)
- isobutanol (C4H9OH)
Sigue con:
Referencias
- “Estudio de algunas propiedades de los alcoholes” en Universidad Autónoma del Estado de Hidalgo. https://www.uaeh.edu.mx/
- “Nomenclatura orgánica: alcoholes” (video) en Quimiayudas. https://www.youtube.com/
- “Alcoholes” (video) https://es.khanacademy.org/
- “Alcohol” https://www.sciencedaily.com/
- “Alcohols” https://courses.lumenlearning.com/
- “Alcohol (chemical compound)” https://www.britannica.com/
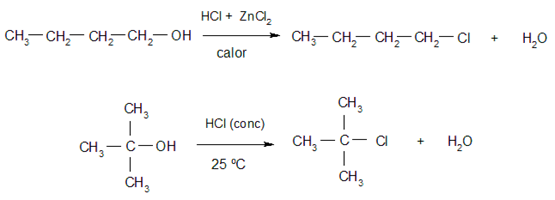

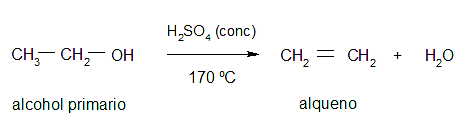




¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)