Te explicamos qué son las reacciones químicas y algunos ejemplos de cómo se presentan en la vida cotidiana. Además, las reacciones químicas en el cuerpo humano.

Una reacción química o fenómeno químico es un proceso en el que una o más especies químicas, llamadas reactivos, reaccionantes o reactantes, se transforman en otras especies químicas, llamadas productos. Por ejemplo: la reacción de combustión que ocurre con el gas en nuestras cocinas para poder cocinar.
Para que ocurra una reacción química, lo reactantivos rompen su estructura molecular y sus enlaces químicos. Luego, se forman nuevos enlaces químicos, lo que indica la formación de los productos.
- Ver además: Cambio químico
1. Cocción de alimentos
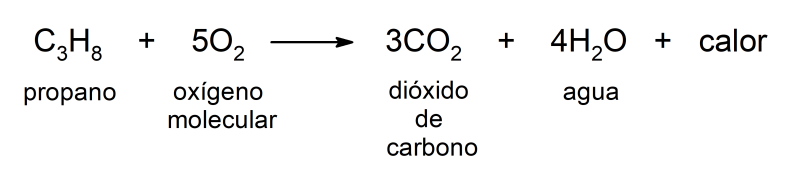
La combustión del gas que ocurre en nuestras cocinas para producir la llama con la que cocinamos los alimentos es una reacción química que libera energía en forma de calor y luz, que es aprovechada para cocinar.
2. Baterías de los autos
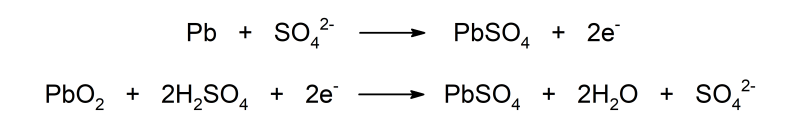
Las baterías de los autos funcionan gracias a una reacción de oxidación-reducción que consiste en la formación de óxido de plomo (PbO2) y en la reducción del sulfato de plomo (PbSO4) a plomo metal durante la carga.
Durante la descarga, en cambio, el óxido de plomo es reducido a sulfato de plomo, y el plomo elemental es oxidado para formar sulfato de plomo.
3. Metal oxidado
La reacción de oxidación del hierro presente en las estructuras metálicas de las construcciones se da cuando el hierro se pone en contacto con el oxígeno atmosférico y el agua.
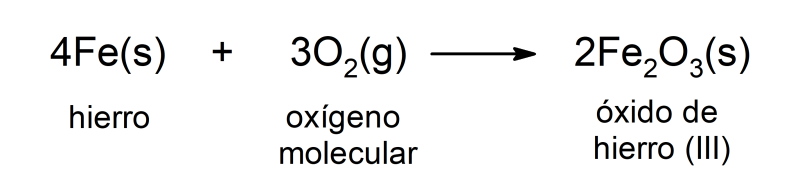
4. Descomposición de materia orgánica
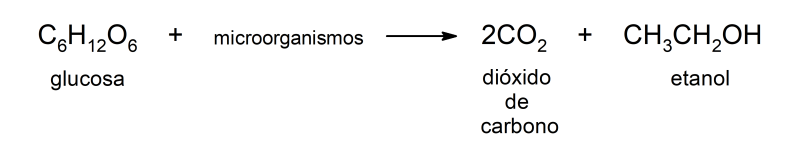
Las reacciones de descomposición de la materia orgánica debido a la acción de distintos microorganismos ocurren cuando la materia orgánica (como desechos de comida, plantas y animales muertos) son descompuestos por ciertos tipos de bacterias y hongos.
5. Encendido de un fósforo
La reacción de combustión del fósforo al encender una cerilla se da cuando una parte del fósforo rojo en la superficie de la cabeza de la cerilla se transforma en fósforo blanco, y este último se enciende al raspar la cabeza contra la caja.
Además, la cabeza de la cerilla contiene compuestos químicos que intervienen en esta reacción química, como clorato de potasio (KClO3) y sulfuro de antimonio (Sb2S3).
Reacciones químicas en el cuerpo humano
Existen diversas reacciones químicas que garantizan el correcto funcionamiento del cuerpo humano. Se denomina metabolismo al conjunto de reacciones químicas que ocurren en el cuerpo humano y que cuando ocurren usan o liberan energía.
Las reacciones químicas que ocurren en el cuerpo humano pueden ser anabólicas o catabólicas.
Reacciones anabólicas
Las reacciones anabólicas son reacciones de síntesis que utilizan energía para combinar especies químicas y formar otras especies químicas nuevas. En estas reacciones se combinan moléculas orgánicas sencillas con otras moléculas orgánicas o con especies químicas inorgánicas para formar moléculas orgánicas más complejas.
Por ejemplo:
- La biosíntesis de proteínas a partir de aminoácidos. Son las reacciones que forman las proteínas necesarias para crear las distintas estructuras y realizar las actividades de nuestro cuerpo. Estas reacciones ocurren en los ribosomas, que son orgánulos celulares.
- La biosíntesis de ácidos grasos. Son las reacciones de formación de los ácidos grasos, necesarios para formar los triglicéridos que sirven como reserva energética del organismo. Estas reacciones ocurren en el citoplasma y en el citosol de la célula.
Reacciones catabólicas
Las reacciones catabólicas son reacciones de degradación que liberan energía para descomponer especies químicas en otras. En estas reacciones se degradan compuestos orgánicos en compuestos orgánicos más simples.
Por ejemplo:
- Las reacciones químicas que ocurren durante la digestión. Se degradan los componentes presentes en los nutrientes que ingerimos en compuestos más simples. Durante la digestión se degradan las proteínas en aminoácidos, los polisacáridos en monosacáridos y los lípidos en ácidos grasos.
- Las reacciones químicas que ocurren durante la respiración. Se oxidan compuestos químicos, principalmente glucosa, para formar dióxido de carbono, agua y liberar energía.
Sigue con:
Referencias
- Loyola, María Dolores de la Llata (2001). Química inorgánica. Editorial Progreso. ISBN 9789706413512. Consultado el 21 de marzo de 2023.
- Moeller, Therald (1981). Química inorgánica. Reverte. ISBN 9788429173901. Consultado el 21 de marzo de 2023.




¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)