Te explicamos qué es la química analítica y en qué se centra esta rama de la química. Además, los métodos analíticos que utiliza.

¿Qué es la química analítica?
Se llama química analítica a una rama de la química que se enfoca en la comprensión de la materia, es decir, del análisis de los materiales que componen alguna muestra, utilizando para ello métodos experimentales o de laboratorio.
La química analítica se puede clasificar en química analítica cuantitativa y cualitativa. La química analítica cuantitativa se emplea para determinar la cantidad, concentración o proporción de uno o varios componentes en una muestra, es decir, se ocupa de cuantificar la materia.
La química analítica cualitativa se emplea para saber cuáles son los componentes de una muestra, es decir, se ocupa de identificar cada componente de la muestra. Por otra parte, la química analítica también se utiliza para la separación de los componentes de una muestra. Generalmente, a la sustancia en cuestión (la que se quiere identificar o cuantificar) se le llama analito.
Los conocimientos que dieron origen a la química analítica surgieron a partir de la idea moderna de la composición química de la materia, surgida en el siglo XVIII.
Un hito importante en el desarrollo de esta disciplina fue la comprensión de la correlación entre las propiedades físicas de la materia y su composición química. En ello, el estudio de la espectroscopía, de la electroquímica y la polarografía fueron fundamentales.
Sin embargo, la invención de métodos de análisis químico que permitieran la comprensión más cabal de la materia avanzaría junto con el desarrollo científico y tecnológico, de modo que las características generales del campo de la química analítica se definirían recién en el siglo XX.
La química analítica emplea los siguientes métodos analíticos para la comprensión de la materia:
Métodos cuantitativos
- Métodos volumétricos. Conocidos como titulación o valoración, son métodos cuantitativos en los que se emplea un reactivo cuya concentración se conoce (sustancia valorante), para determinar la de otro reactivo cuya concentración se desconoce (analito o sustancia a analizar en la muestra), mediante una reacción química En las titulaciones, por lo general, se usan indicadores que marcan el punto final de la reacción. Existen diferentes tipos de titulaciones:
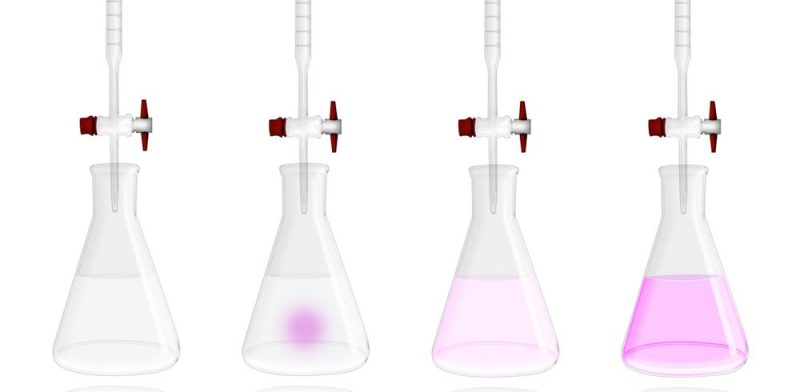
- Titulaciones ácido-base. Son aquellas en las que se hace reaccionar un ácido con una base empleando un indicador ácido-base. Por lo general, se coloca la base en una bureta (recipiente químico que sirve para medir volúmenes) y en un erlenmeyer se coloca un volumen conocido del ácido con unas gotas de fenolftaleína (indicador) agregadas. La fenolftaleína toma color rosa en medio básico y es incolora en medio ácido. Entonces el método consiste en ir añadiendo la base al ácido hasta que la disolución final se torne rosa, lo que significa que la reacción entre el ácido y la base llegó a su punto final. Un instante antes de llegar al punto final, la reacción llega a su punto de equivalencia, que es donde la cantidad de sustancia del valorante es igual a la cantidad de sustancia del analito. Si en la reacción la estequiometría es 1:1, es decir, que reaccionan la misma cantidad de sustancia de analito que de valorante, se puede emplear la siguiente ecuación para determinar la cantidad de analito:

Donde:
[X] es la concentración conocida de la sustancia X, expresada mol/L o unidades equivalentes.
V(X) es el volumen de la sustancia X dispensado de la bureta, expresado en L o unidades equivalentes.
[Y] es la concentración desconocida del analito Y, expresada en mol/L o unidades equivalente.
V(Y) es el volumen de la sustancia Y contenida en el erlenmeyer, expresado en L o unidades equivalentes.
Es importante aclarar que, si bien esta ecuación es muy utilizada, muchas veces varía dependiendo del tipo de titulación que se emplee. - Titulaciones redox. El fundamento es el mismo que en las titulaciones ácido-base, pero en este caso se tiene una reacción redox entre el analito y una disolución oxidante o reductora, según sea el caso. El indicador empleado puede ser un potenciómetro (equipo para medir diferencia de potencial) o un indicador redox (compuestos que tienen un color definido en cada uno de sus estados de oxidación).
- Titulaciones de formación de complejos. Consisten en la reacción de formación de complejos entre el analito y la sustancia valorante.
- Titulaciones de precipitación. Consisten en la formación de un precipitado. Son muy específicas y los indicadores utilizados son muy particulares de cada reacción.
- Titulaciones ácido-base. Son aquellas en las que se hace reaccionar un ácido con una base empleando un indicador ácido-base. Por lo general, se coloca la base en una bureta (recipiente químico que sirve para medir volúmenes) y en un erlenmeyer se coloca un volumen conocido del ácido con unas gotas de fenolftaleína (indicador) agregadas. La fenolftaleína toma color rosa en medio básico y es incolora en medio ácido. Entonces el método consiste en ir añadiendo la base al ácido hasta que la disolución final se torne rosa, lo que significa que la reacción entre el ácido y la base llegó a su punto final. Un instante antes de llegar al punto final, la reacción llega a su punto de equivalencia, que es donde la cantidad de sustancia del valorante es igual a la cantidad de sustancia del analito. Si en la reacción la estequiometría es 1:1, es decir, que reaccionan la misma cantidad de sustancia de analito que de valorante, se puede emplear la siguiente ecuación para determinar la cantidad de analito:
- Métodos gravimétricos.Método cuantitativo que consiste en medir el peso de un material o sustancia antes y después de hacerle algún cambio. El instrumento para realizar la medición generalmente es una balanza analítica. Existen varios métodos gravimétricos:
- Precipitación. Consiste en la formación de un precipitado, de forma que al pesarlo, se pueda calcular su cantidad en la muestra original utilizando relaciones estequiométricas. El precipitado puede ser colectado de la disolución en que se encuentre mediante filtración. Para aplicar este método el analito debe ser poco soluble y ser bien definido químicamente.
- Volatilización. Consiste en volatilizar el analito para separarlo de la muestra. Luego se recupera el analito mediante su absorción en algún material, se pesa este material, y la ganancia de peso se deberá a la incorporación del analito, cuyo peso se calculará por la diferencia de pesos del material absorbente antes y después de haber absorbido el analito. Este método solo puede aplicarse cuando el analito es la única sustancia volátil en la muestra.
- Electrodeposición. Consiste en una reacción redox donde el analito se deposita sobre un electrodo formando parte de un compuesto. Luego se pesa el electrodo antes y después de la reacción redox, de esta forma se puede calcular la cantidad de analito depositada.
Métodos instrumentales más avanzados:
- Métodos espectrométricos. Se emplean aparatos para medir el comportamiento de la radiación electromagnética (luz) en contacto con la sustancia o el compuesto que se analiza.
- Métodos electroanalíticos. Semejante al espectrométrico, pero se emplea la electricidad en lugar de la luz para medir el potencial eléctrico o la corriente eléctrica transmitida por la sustancia que se quiere analizar.
- Métodos cromatográficos. La cromatografía es un método de separación, caracterización y cuantificación de mezclas complejas. Se utiliza para separar uno o varios componentes de una mezcla y a la vez identificarlos y calcular su concentración o cantidad en la muestra, o sea, cuantificarlos. El método cromatográfico consiste básicamente en una fase estacionaria y una fase móvil que forman parte de un equipo o estructura que se utiliza para analizar la muestra. La fase estacionaria es inmóvil y consiste en una sustancia que se adhiere a algún sistema diseñado generalmente en forma de columna y la fase móvil es una sustancia (líquida o gaseosa) que fluye a través de la fase estacionaria. La separación de los componentes (analitos) ocurre según la afinidad de cada uno de ellos por la fase estacionaria o por la fase móvil, lo que dependerá de diversas propiedades tanto químicas como físicas (de cada uno o de ambas fases). Existen distintos tipos de cromatografía dependiendo de las sustancias utilizadas como fase móvil y estacionaria, de las condiciones impuestas al método y de los diseños de los equipos cromatográficos. Por ejemplo, en la siguiente imagen se puede ver la separación de los distintos componentes de una mezcla que fue inyectada en una columna cromatográfica. Se pueden observar los diferentes colores de cada componente a medida que descienden por la fase estacionaria que rellena la columna:

Ver además: Ley de Conservación de la Materia
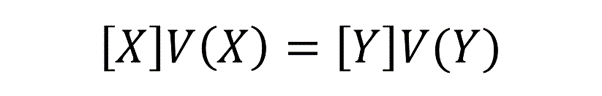


¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)