Te explicamos qué es la tabla periódica de los elementos, cómo se organiza por grupos. Además, su historia y la tabla periódica completa.
¿Qué es la tabla periódica de los elementos?
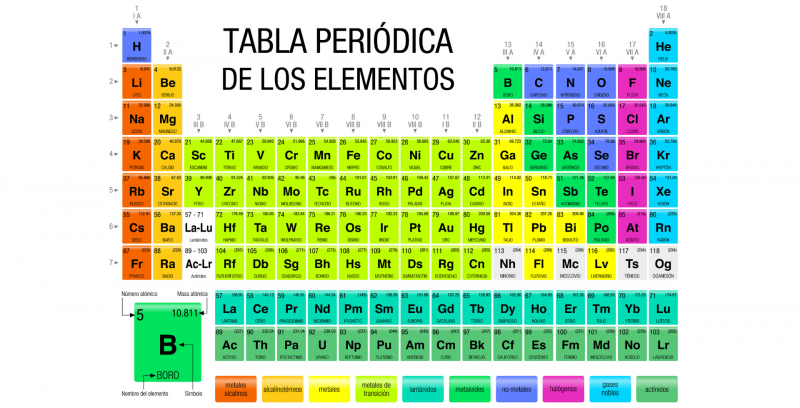
La tabla periódica de los elementos es un registro de todos los elementos químicos conocidos por la humanidad. Los elementos están ordenados en forma de tabla según su número atómico (número de protones), su configuración electrónica y sus propiedades químicas.
En esta tabla los elementos están organizados en filas y columnas que muestran cierta periodicidad: los elementos que pertenecen a una misma columna tienen propiedades similares. En principio, toda la materia conocida del universo está compuesta por diversas combinaciones de los 118 elementos, registrados en la tabla periódica.
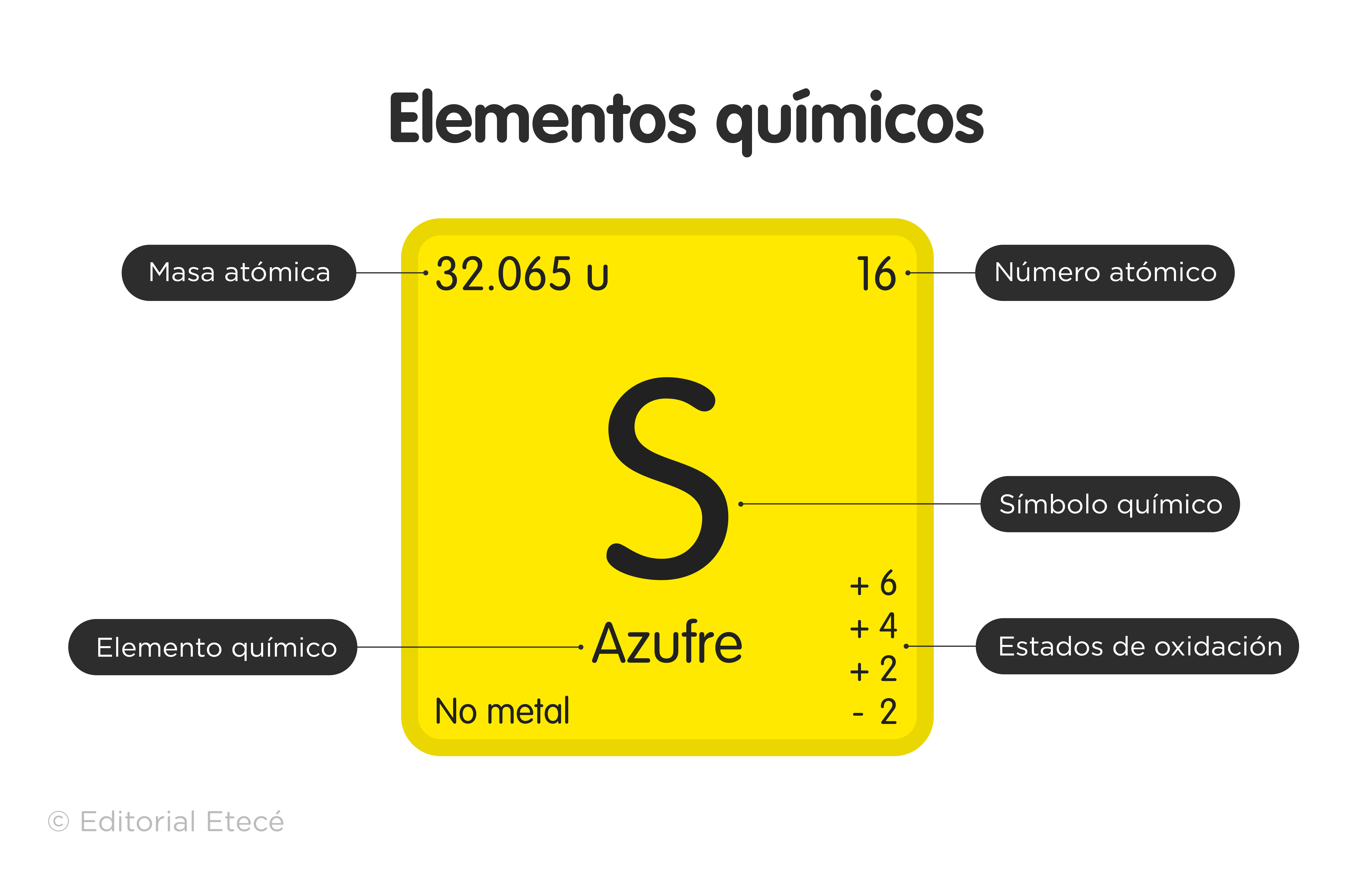
Se han establecido símbolos, llamados símbolos químicos, para representar a cada elemento de la tabla periódica, que además están identificados según sus estados de agregación (sólido, líquido o gas) a una temperatura de 0 °C y a una presión de 1atm.
La tabla periódica es una herramienta fundamental para la química, la biología y otras ciencias naturales, que se actualiza con el pasar de los años, conforme aprendemos más sobre las propiedades de la materia y las relaciones entre los elementos.
Ver también: Enlace químico
¿Cómo está organizada la tabla periódica?
La tabla periódica actual está estructurada en siete filas (horizontales) denominadas períodos y en 18 columnas (verticales) llamadas grupos o familias. Los elementos químicos están ordenados en orden creciente de sus números atómicos, es decir, el número atómico aumenta de izquierda a derecha en el período y de arriba hacia abajo en el grupo.
Los dieciocho grupos conocidos son:
- Grupo 1 (IA). Los metales alcalinos: litio (Li), sodio (Na), potasio (K), rubidio (Rb), cesio (Cs), francio (Fr). Además en este grupo se encuentra el hidrógeno (H), que es un gas.
- Grupo 2 (IIA). Los metales alcalinotérreos: berilio (Be), magnesio (Mg), calcio (Ca), estroncio (Sr), bario (Ba), radio (Ra).
- Grupo 3 (IIIB). La familia del escandio (Sc), que incluye al Itrio (Y) y a las tierras raras: lantano (La), cerio (Ce), praseodimio (Pr), neodimio (Nd), prometio (Pm), samario (Sm), europio (Eu), gadolinio (Gd), terbio (Tb), disprosio (Dy), holmio (Ho), erbio (Er), tulio (Tm), iterbio (Yt), lutecio (Lu). También se incluyen a los actínidos: actinio (Ac), torio (Th), protactinio (Pa), uranio (U), neptunio (Np), plutonio (Pu), americio (Am), curio (Cm), berkelio (Bk), californio (Cf), einstenio (Es), fermio (Fm), mendelevio (Md), nobelio (No) y lawrencio (Lr).
- Grupo 4 (IVB). La familia del titanio (Ti), que incluye el circonio (Zr), el hafnio (Hf) y el rutherfordio (Rf), este último sintético y radiactivo.
- Grupo 5 (VB). La familia del vanadio (V): niobio (Nb), tántalo (Ta) y dubnio (Db), este último es sintético.
- Grupo 6 (VIB). La familia del cromo (Cr): molibdeno (Mb), wolframio (W) y seaborgio (Sg), este último es sintético.
- Grupo 7 (VIIB). La familia del manganeso (Mn): renio (Re), tecnecio (Tc) y bohrio (Bh), estos dos últimos son sintéticos.
- Grupo 8 (VIIIB). La familia del hierro (Fe): rutenio (Ru), osmio (Os) y hassio (Hs), este último sintético.
- Grupo 9 (VIIIB). La familia del cobalto (Co): rodio (Rh), iridio (Ir) y el sintético meitneiro (Mt).
- Grupo 10 (VIIIB). La familia del níquel (Ni): paladio (Pd), platino (Pt) y el sintético darmstadtio (Ds).
- Grupo 11 (IB). La familia del cobre (Cu): plata (Ag), oro (Au) y el sintético roentgenio (Rg).
- Grupo 12 (IIB). La familia del zinc (Zn): cadmio (Cd), mercurio (Hg) y el sintético copernicio (Cn).
- Grupo 13 (IIIA). Los térreos: boro (Br), aluminio (Al), galio (Ga), indio (In), talio (Tl) y el sintético nihonio (Nh).
- Grupo 14 (IVA). Los carbonoideos: carbono (C), silicio (Si), germanio (Ge), estaño (Sn), plomo (Pb) y el sintético flevorio (Fl).
- Grupo 15 (VA). Los nitrogenoideos: nitrógeno (N), fósforo (P), arsénico (As), antimonio (Sb), bismuto (Bi) y el sintético moscovio (Mc).
- Grupo 16 (VIA). Los calcógenos o anfígenos: oxígeno (O), azufre (S), selenio (Se), teluro (Te), polonio (Po) y el sintético livermorio (Lv).
- Grupo 17 (VIIA). Los halógenos: flúor (F), cloro (Cl), bromo (Br), yodo (I), astato (At) y el sintético teneso (Ts).
- Grupo 18 (VIIIA). Los gases nobles: helio (He), neón (Ne), argón (Ar), kriptón (Kr), xenón (Xe), radón (Rn) y el sintético oganesón (Og).
Ver también: Grupos de la tabla periódica
Historia de la tabla periódica
La primera versión de la tabla periódica fue publicada en 1869 por el profesor de química ruso Dmitri Mendeléyev, y contenía 63 de los 118 elementos hoy conocidos en la naturaleza y estaba organizada basándose en sus propiedades químicas. Por otra parte, el profesor de química alemán Julius Lothar Meyer publicó una versión ampliada pero basándose en las propiedades físicas de los átomos. Ambos estudiosos organizaron los elementos en filas, teniendo la previsión de dejar espacios en blanco en donde intuían que habrían elementos aún por descubrir.
En 1871 Mendeléyev publicó otra versión de la tabla periódica que agrupaba los elementos según sus propiedades comunes en columnas enumeradas desde la I hasta la VIII conforme al estado de oxidación del elemento.
Finalmente, en 1923 el químico americano Horace Groves Deming publicó una tabla periódica con 18 columnas identificadas que constituye la versión utilizada actualmente.
Ver además: Historia de la tabla periódica
Referencias
- «El ABC de la Tabla Periódica» en Química y Sociedad. (PDF) https://www.quimicaysociedad.org/
- «Química Inorgánica» de María Dolores de la Llata Loyola. Editorial Progreso (2001) ISBN: 9789706413536.
- «Química Inorgánica» de Therald Moeller. Nueva versión puesta al día, Editorial Reverté, S. A. ISBN: 8429173919.

¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)