Te explicamos qué es un enlace covalente, sus características y tipos. Además, ejemplos y diferencia con enlace iónico.

¿Qué es un enlace covalente?
El enlace covalente es un tipo de enlace químico que ocurre cuando dos átomos se enlazan para formar una molécula, compartiendo electrones pertenecientes a su capa de valencia o último nivel de energía, alcanzando gracias a ello el conocido “octeto estable”, conforme a la “regla del octeto” propuesto por Gilbert Newton Lewis sobre la estabilidad electrónica de los átomos.
La “regla del octeto” plantea que los iones de los elementos químicos ubicados en la Tabla Periódica, tienden a completar sus últimos niveles de energía con 8 electrones, y esta configuración electrónica les confiere una gran estabilidad, que es muy similar a la de los gases nobles.
Los átomos enlazados por enlaces covalentes comparten uno o más pares de electrones de su último nivel de energía. Se denomina orbital molecular a la región del espacio donde está ubicada la densidad electrónica en la molécula.
Esta densidad electrónica se puede definir y calcular utilizando ecuaciones matemáticas muy complejas que describen el comportamiento de los electrones en las moléculas.
Por otro lado, también existen los orbitales atómicos, que se definen como la región del espacio que representa la probabilidad de encontrar un electrón alrededor del núcleo atómico. Así, cuando se combinan varios orbitales atómicos, se generan orbitales moleculares. Además, los enlaces covalentes se forman por compartimiento de electrones entre los átomos que se enlazan.
El enlace covalente se forma entre átomos que no tienen una gran diferencia de electronegatividad. Este enlace se puede formar entre átomos no metálicos, o entre átomos metálicos y el hidrógeno. E enlace iónico se forma entre iones de átomos con una elevada diferencia de electronegatividad, y suele formarse entre iones de átomos de elementos metálicos e iones de átomos de elementos no metálicos.
Es importante aclarar que no existe un enlace absolutamente covalente, o un enlace absolutamente iónico. De hecho, muchas veces se suele considerar al enlace iónico como una “exageración” del enlace covalente.
Ver además: Enlace metálico
Tipos de enlace covalente
Conforme a la presencia o no de polaridad (propiedad de algunas moléculas de separar las cargas eléctricas en su estructura), se puede distinguir entre enlaces covalentes polares (que forman moléculas polares) y enlaces covalentes no polares (que forman moléculas no polares):
- Enlaces covalentes polares. Se enlazan átomos de distintos elementos y con diferencia de electronegatividad por encima de 0,5. Así, la molécula tendrá la densidad de carga negativa sobre el átomo más electronegativo, pues este átomo atrae con mayor fuerza los electrones del enlace, mientras que sobre el átomo menos electronegativo quedará una densidad de carga positiva. La separación de las densidades de carga genera dipolos electromagnéticos.
- Enlaces covalentes no polares. Se enlazan átomos de un mismo elemento, o de distintos elementos, pero con similares electronegatividades, con una diferencia de electronegatividad menor que 0,4. La nube electrónica es atraída con igual intensidad por ambos núcleos y no se forma un dipolo molecular.
También existen los siguientes tipos de enlace covalente, a partir de la cantidad de electrones compartidos por los átomos enlazados:
- Enlace covalente simple. Los átomos enlazados comparten un par de electrones de su última capa electrónica (un electrón cada uno). Se representa por una línea en el compuesto molecular. Por ejemplo: H-H (Hidrógeno-Hidrógeno), H-Cl (Hidrógeno-Cloro).
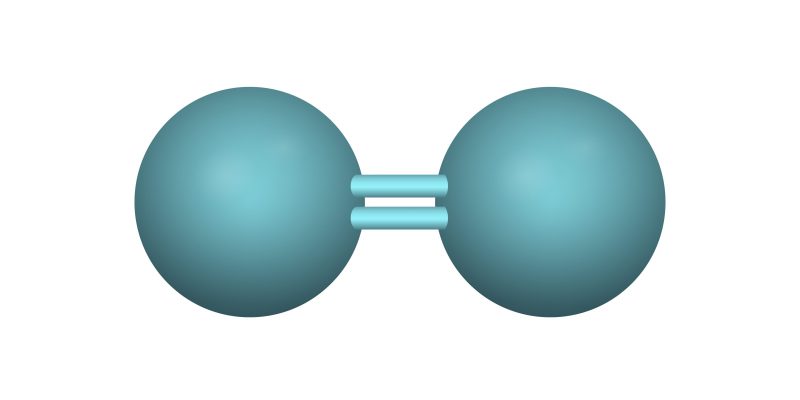
- Enlace covalente doble. Los átomos enlazados aporta cada uno dos electrones de su última capa de energía, formando un enlace de dos pares de electrones. Se representa por dos líneas paralelas, una arriba y una abajo, similar al signo matemático de igualdad. Por ejemplo: O=O (Oxígeno-Oxígeno), O=C=O (Oxígeno-Carbono-Oxígeno).
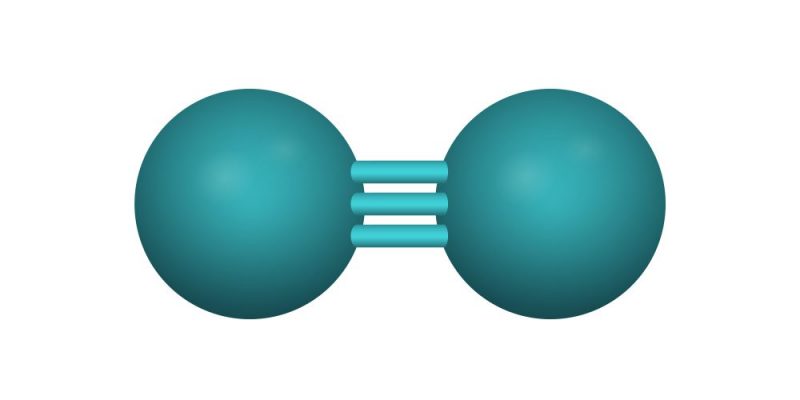
- Enlace covalente triple. Este enlace se forma por tres pares de electrones, es decir, cada átomo aporta 3 electrones de su última capa de energía. Se representa por tres líneas paralelas, ubicadas una arriba, otra en el medio y la otra debajo. Por ejemplo: N≡N (Nitrógeno-Nitrógeno).
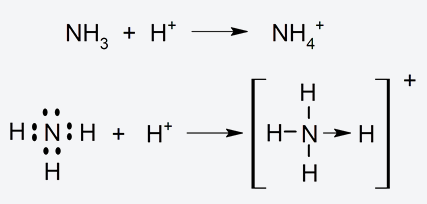
- Enlace covalente dativo. Un tipo de enlace covalente en que uno solo de los dos átomos enlazados aporta dos electrones y el otro, en cambio, ninguno. Se representa con una flecha en el compuesto molecular. Por ejemplo: el ion amonio:

Ejemplos de enlace covalente
Ejemplos sencillos de enlace covalente son los que se dan en las siguientes moléculas:
- Oxígeno puro (O2). O=O (un enlace doble)
- Hidrógeno puro (H2). H-H (un enlace simple)
- Dióxido de carbono (CO2). O=C=O (dos enlaces dobles)
- Agua (H2O). H-O-H (dos enlaces simples)
- Ácido clorhídrico (HCl). H-Cl (un enlace simple)
- Nitrógeno puro (N2). N≡N (un enlace triple)
- Ácido cianhídrico (HCN). H-C≡N (un enlace simple y uno triple)
Diferencia entre enlace covalente e iónico
Los enlaces covalentes son aquellos que ocurren debido a que comparten electrones entre los átomos que se enlazan. Se diferencian de los enlaces iónicos en que en estos últimos ocurre una transferencia de electrones entre los átomos involucrados en el enlace iónico (no se comparten electrones).
Para que se forme un enlace iónico, un átomo transfiere uno o varios electrones a otro átomo, y el enlace se forma por interacción electrostática entre ambos átomos que quedan cargados eléctricamente, pues al ocurrir la transferencia de electrones un átomo (el que cedió electrones) quedó con carga positiva (catión) y el otro átomo (el que aceptó electrones) quedó con carga negativa (anión).
Sigue con:
Referencias
- Enlace covalente. Encyclopedia Britannica. https://www.britannica.com/
- Bonding summary. Encyclopedia Britannica. https://www.britannica.com/
- Enlace químico. Universidad de Alicante. https://rua.ua.es/





¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)