Te explicamos qué es la teoría atómica y cómo evolucionaron sus propuestas, con un resumen de su historia. Además, sus diferentes descubrimientos.

¿Qué es la teoría atómica?
La teoría atómica es una teoría científica que surgió con el objetivo de describir y explicar la composición de la materia. Esta teoría propone que la materia está formada por unidades discretas llamadas átomos, que se consideraron partículas indivisibles hasta que se descubrieron las partículas subatómicas que los forman: el electrón, el neutrón y el protón.
Desde tiempos remotos, han surgido ideas sobre la composición atómica de la materia. Antiguamente, en las escuelas hinduistas Nyaya y Vaisheshika se manejaba la idea de que la materia está formada por átomos. Esta idea fue seguida por los griegos y luego por el naturalista, matemático, químico y meteorólogo británico John Dalton.
Así, a través de los años, fueron surgiendo nuevas ideas y nuevos modelos propuestos por diferentes científicos para describir la estructura de los átomos que componen la materia.
- Ver también: Modelos atómicos
Evolución de la teoría atómica
Algunas ideas iniciales sobre la composición de la materia surgieron en India, en las escuelas Nyaya y Vaisheshika, donde proponían que la materia estaba formada por átomos.
Además, aunque aún no estaba totalmente instaurada y fundamentada la idea de la existencia de los átomos, surgieron leyes químicas que describen las reacciones químicas. Una de ellas es la ley de conservación de la masa (1789), que plantea que en una reacción química la masa total de reactivos consumidos es igual a la masa total de productos formados. Y también la ley de las proporciones constantes (1799), que plantea que cuando se descompone un compuesto químico en los elementos que lo forman, las masas de estos elementos tendrán las mismas proporciones.
Estas ideas estuvieron basadas principalmente en fundamentos filosóficos y teológicos, y no en la observación y en la experimentación, es decir, no tenían bases científicas. Así, a este conjunto de ideas o línea de pensamiento se le llamó atomismo filosófico.
El entendimiento y comprensión de cómo fueron evolucionando las distintas teorías y modelos atómicos es muy importante para el desarrollo de nuevas teorías y modelos atómicos que expliquen de manera más acertada la estructura y las propiedades de los átomos. Con el transcurso de los años distintos estudiosos comenzaron a proponer diferentes teorías atómicas y modelos atómicos asociados que, con el avance de la tecnología, cada vez fueron más verificados y corregidos.
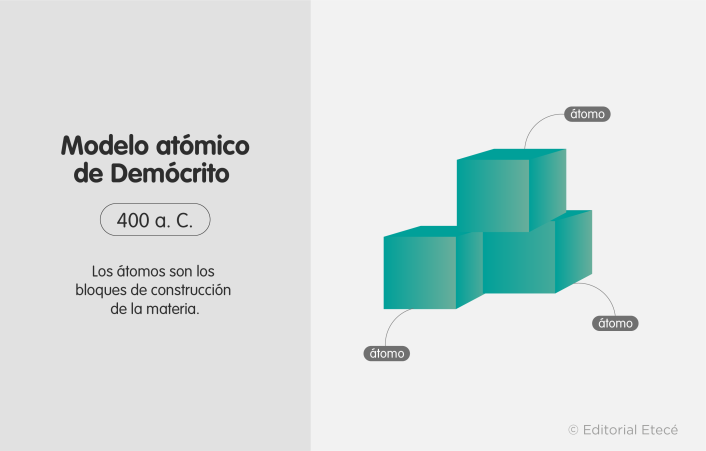
1. Modelo atómico de Demócrito (460 a. C.)
El modelo atómico de Demócrito fue propuesto por el filósofo y polímata griego Demócrito de Abdera, que además fue discípulo de Leucipo (fundador del atomismo).
Este modelo plantea que los átomos son los bloques de construcción del universo y que son eternos, indivisibles, indestructibles y homogéneos. Además, no considera su estructura interna y solo afirma que se diferencian en su forma y tamaño.
- Más en: Modelo atómico de Demócrito
2. Modelo atómico de Dalton (1803-1808)
El modelo atómico de Dalton fue propuesto entre 1803 y 1808 por el químico, matemático y meteorólogo británico John Dalton.
Este modelo establece que los átomos de un mismo elemento químico son iguales, tienen las mismas propiedades químicas y no pueden ser destruidos mediante reacciones químicas.
Esta conclusión pudo ser demostrada mediante experimentos, por lo que se considera la primera teoría completamente científica del átomo. Además, plantea que:
- Los átomos son indivisibles.
- Los átomos de uno o más elementos químicos pueden formar compuestos químicos cuando se unen.
- Los átomos de elementos químicos diferentes pueden formar compuestos químicos distintos según las proporciones en que se hayan unido.
- Los átomos se combinan en proporciones simples para formar un compuesto químico.

Más en:
3. Modelo atómico de Thomson (1904)
El modelo atómico de Thomson fue propuesto en 1904 por el ingeniero y matemático inglés Joseph John Thomson.
Este modelo establece que el átomo tiene una forma similar a un budín con pasas de uva. Así, los átomos están constituidos por electrones que se encuentran esparcidos en una esfera de carga positiva, similar a como se encuentran las pasas en un budín. Por eso es conocido este modelo como el budín de pasas.

- Más en: Modelo atómico de Thomson
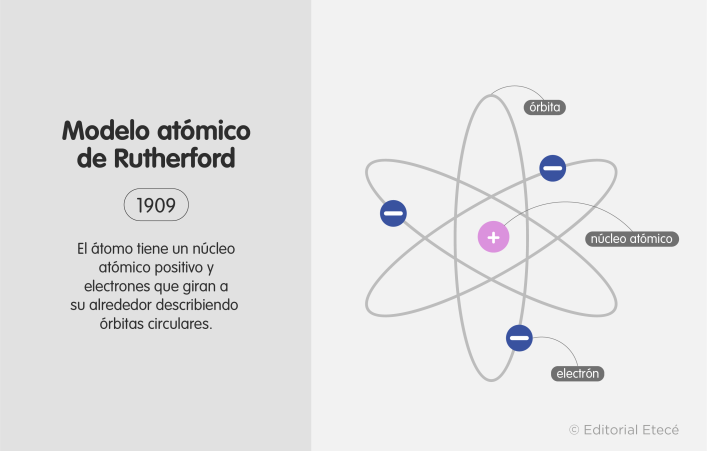
4. Modelo atómico de Rutherford (1911)
El modelo atómico de Rutherford fue propuesto en 1911 por el físico neozelandés Ernest Rutherford. Este modelo establece que el átomo está formado por un núcleo atómico y electrones que giran a su alrededor.
Plantea la existencia del núcleo atómico, es decir, una región con carga positiva concentrada, que descubrió mediante el experimento de la lámina de oro. En este experimento se bombardeó una lámina de oro con partículas alfa y se pudo observar cómo parte de estas se desviaban con ángulos considerables, lo que evidenció la existencia de una región con carga positiva concentrada: el núcleo atómico.
- Más en: Modelo atómico de Rutherford
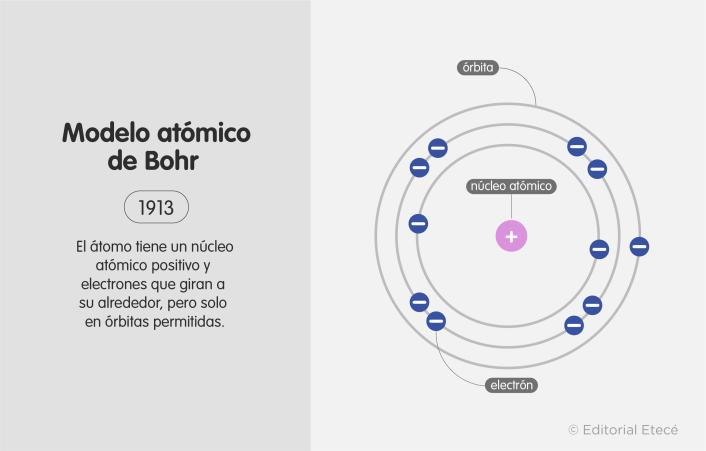
5. Modelo atómico de Bohr (1913)
El modelo atómico de Bohr fue propuesto en 1913 por el físico danés Niels Henrik David Bohr. Plantea que el átomo está formado por un núcleo y electrones girando a su alrededor, pero con trayectorias en órbitas específicas o permitidas.
Por otro lado, plantea que los electrones saltan solo entre órbitas permitidas, cediendo o absorbiendo energía.
- Más en: Modelo atómico de Bohr
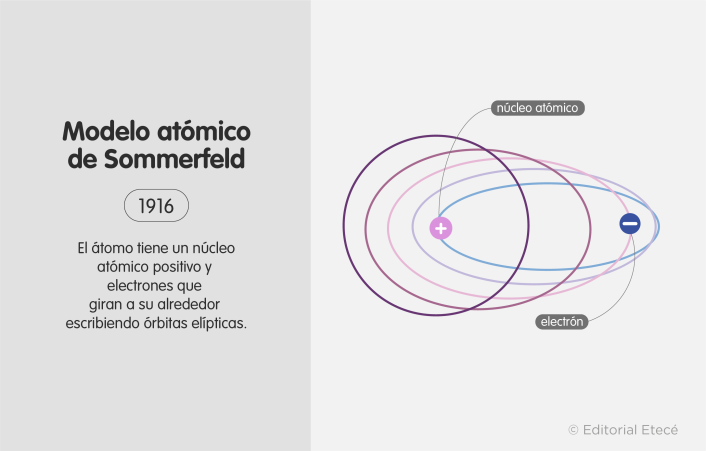
6. Modelo atómico de Sommerfeld (1916)
El modelo atómico de Sommerfeld fue propuesto en 1916 por el físico alemán Arnold Sommerfeld. Este modelo plantea que el átomo está formado por un núcleo y que los electrones giran a su alrededor describiendo órbitas elípticas.
Además, propone que el núcleo atómico también se mueve junto con los electrones y ambos se mueven alrededor del centro de masas del sistema.
- Más en: Modelo atómico de Sommerfeld
7. Modelo atómico de Schrödinger (1926)
El modelo atómico de Schrödinger fue propuesto en 1926 por el físico y filósofo austríaco Erwin Rudolf Josef Alexander Schrödinger. Este modelo plantea que el átomo está formado por un núcleo atómico con nubes electrónicas que representan a los electrones. Además, establece que los electrones se comportan como ondas y como partículas.

- Más en: Modelo atómico de Schrödinger
Descubrimiento de las partículas subatómicas
El descubrimiento de las partículas atómicas jugó un papel muy importante en el desarrollo y evolución de la teoría atómica. A partir del conocimiento de la existencia de las partículas atómicas, se pudo describir la composición interna del átomo, lo que permitió estudiar y comprender sus propiedades nucleares y electrónicas.
El electrón (1897)
La primera partícula subatómica constituyente del átomo que se descubrió fue elelectrón. Fue descubierto en 1897 por Joseph John Thomson mediante su experimento con rayos catódicos.
Thomson realizó un experimento con un tubo de rayos catódicos, que consistió en un recipiente de vidrio cerrado al vacío con dos electrodos en su interior. Al aplicar una diferencia de potencial a los electrodos, se generan rayos catódicos, que crean una huella fosforescente sobre el lado opuesto del tubo de cristal.
Además, Thomson aplicó un campo eléctrico a este sistema y descubrió que los rayos se desviaban, es decir, que había partículas cargadas eléctricamente que interactuaban con la electricidad. Así, llamó “corpúsculos” a estas partículas que más tarde fueron llamadas “electrones” por otros científicos.
De esta manera, Thomson supuso que los electrones provenían de los átomos del electrodo y que estos átomos estaban compuestos por partículas pequeñas (los electrones) distribuidas en una región positiva. Siguiendo esta conclusión, también se podía explicar la neutralidad de los átomos.
- Ver también: Electrón
El protón (1918)
En 1918, Ernest Rutherford descubrió el protón mediante un experimento en el que disparaba partículas alfa (núcleos de helio con carga positiva) a un gas de nitrógeno. En este experimento detectó que aparecían núcleos de hidrógeno, pero el gas era nitrógeno, y no hidrógeno.
Entonces, como se conocía que el núcleo del hidrógeno tiene carga 1, Rutherford propuso que los supuestos núcleos de hidrógeno que aparecieron eran en realidad partículas positivas de carga eléctrica positiva elemental de 1, es decir, protones.
- Ver además: Protón
El neutrón (1932)
En el año 1932, el físico inglés James Chadwick declaró el descubrimiento del neutrón mediante un conjunto de experimentos en los que bombardeaba berilio (Be) con partículas alfa. En estos experimentos descubrió que existe una partícula con masa similar a la del protón, pero que no tiene carga.
El desarrollo de nuevas tecnologías y los constantes estudios han permitido que continuamente se sigan descubriendo nuevas partículas más pequeñas que el átomo, como los quarks, los positrones y los antiprotones, entre otras.
- Ver también: Neutrón
Descubrimiento del núcleo atómico (1911)
El núcleo atómico fue descubierto por Ernest Rutherford en el año 1911. Realizó este descubrimiento mediante un experimento donde bombardeó una lámina de oro con partículas alfa (que tienen carga positiva). Por otra parte, colocó una pantalla fluorescente para detectar el patrón de los impactos de las partículas alfa.
Rutherford pudo observar que la mayoría de las partículas alfa impactaban en la pantalla sin ser desviadas, pero una pequeña fracción de ellas eran desviadas con ángulos de más de 90⁰. Así, pudo concluir que esta pequeña fracción de partículas alfa estaba siendo desviada por su interacción con una región de carga positiva concentrada que existe en los átomos, el núcleo atómico.
Este descubrimiento corrigió el modelo atómico propuesto por Thomson, que no consideraba la existencia de un núcleo atómico, pues proponía que el átomo estaba formado por una región esférica positiva con los electrones distribuidos en ella.
Sigue con:
Referencias
- Casabo Gispert Jaume. (2014) Estructura Atómica y Enlace Químico. 1era Edición. Editorial Reverté. ISBN: 9788429171150
- Atkins Peter, de Paula Julio. (2020) Química Física. 8va Edición. Editorial Médica Panamericana. ISBN: 9789500696418
- Thomson, J. J. (1897): Cathode rays. Philosophical Magazine and Journal of Science.




¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)