Te explicamos qué es el carbono, características, propiedades y usos. También, información sobre el carbono, compuestos químicos que puede formar, isótopos.

¿Qué es el carbono?
El carbono es un elemento químico de la Tabla Periódica que se representa con el símbolo C. Es el principal componente en la estructura de los compuestos orgánicos, que son imprescindibles para formar las moléculas que constituyen los seres vivos.
Su número atómico es 6 y su masa atómica es 12.01 uma. Es un elemento químico no metálico que forma compuestos químicos tanto orgánicos (compuestos que tienen su estructura principal basada en el carbono) como inorgánicos (compuestos que contienen carbono, pero que su estructura principal no está basada en el carbono).
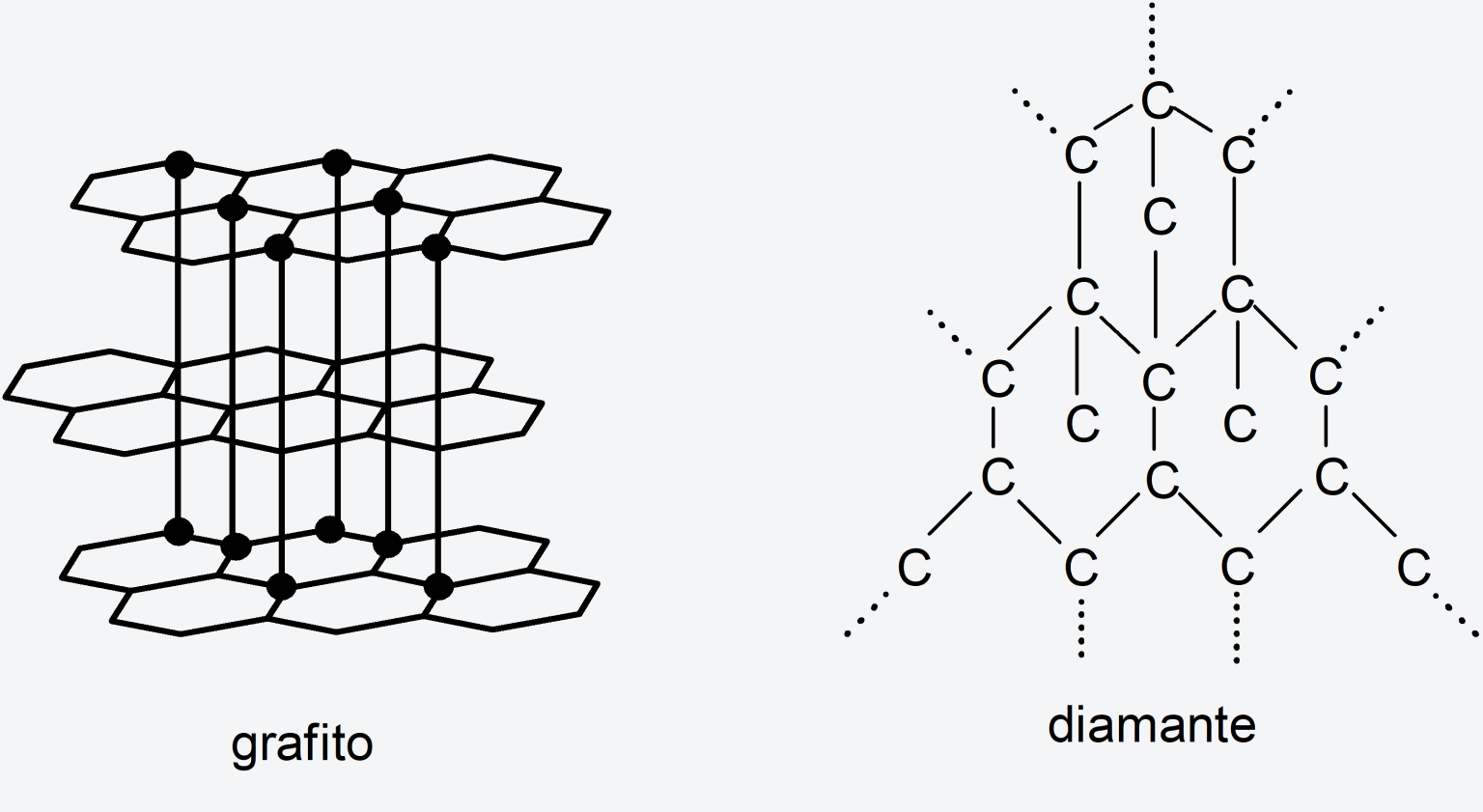
Por otra parte, los átomos de carbono se pueden enlazar de distintas maneras para formar distintos alótropos. Los alótropos del carbono son las distintas sustancias simples que puede formar este elemento químico dependiendo de cómo se enlazan sus átomos. Por ejemplo: el diamante y el grafito, son alótropos del carbono.
Ver además: Ciclo del carbono
Propiedades del carbono

El carbono puede formar parte de compuestos químicos orgánicos e inorgánicos. Además, puede tener distintos aspectos y propiedades que varían según el alótropo que forma este elemento.
Propiedades físicas del carbono
Las propiedades físicas que comparten todos los alótropos del carbono son:
- Son sólidos a 20 °C y 1 atm.
- No son solubles en agua.
Sin embargo, hay propiedades que varían dependiendo de qué alótropo del carbono se trate, si del diamante o el grafito, que son sus alótropos más conocidos. Así, podemos afirmar que:
Cuando forma grafito:
- es blando
- es de color negro
- conduce la electricidad
- tiene un punto de fusión de 3527 °C
Cuando forma diamante:
- es muy duro
- es de aspecto transparente
- no conduce la electricidad
- tiene una alta capacidad de conducir el calor
- tiene un punto de fusión de 3823070 °C
Propiedades químicas del carbono
Las propiedades químicas del carbono son:
- Tiene principalmente estado de oxidación +4.
- Reacciona con oxígeno para formar monóxido de carbono (CO), dióxido de carbono (CO2) y dióxido de tricarbono (C3O2).
- Experimenta distintas reacciones químicas que dependen del compuesto orgánico que está formando este elemento químico. Por ejemplo:
La combustión de alcanos.
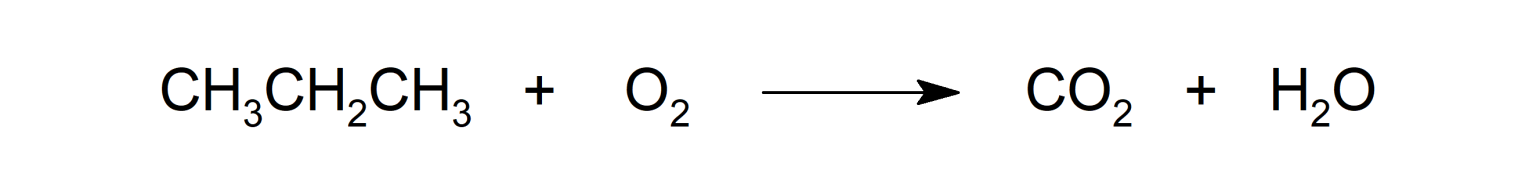
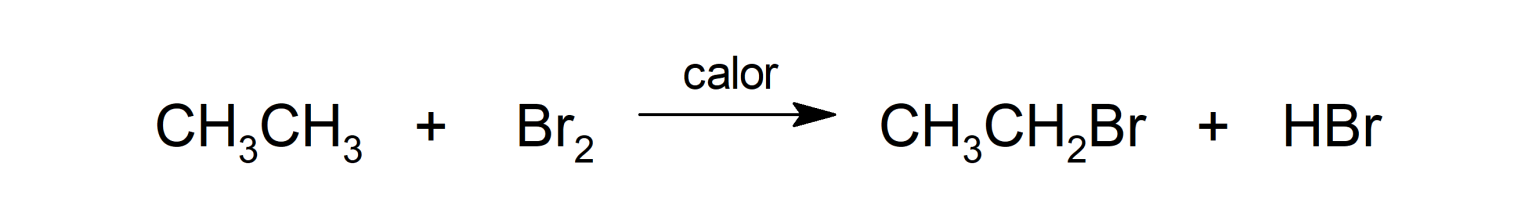
La reacción de alcanos con cloro (Cl2) y bromo (Br2).
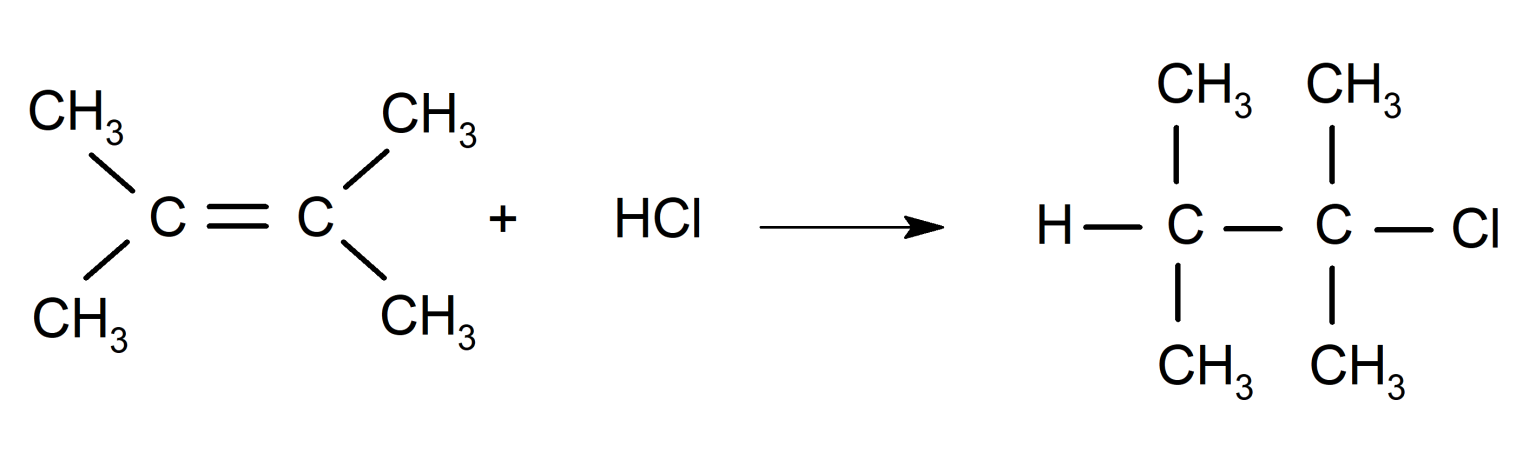
La reacción de alquenos con ácido clorhídrico (HCl).
¿Para qué sirve el carbono?

El carbono forma la parte principal de los combustibles fósiles, como el petróleo y el gas natural. Es por esto que se utiliza como combustible (gasolina, diésel) para generar energía eléctrica y para el funcionamiento de los vehículos, como autos, trenes y aviones.
Además, tiene múltiples usos como, por ejemplo:
- Se utiliza como materia prima en la producción de plásticos.
- Se emplea en la fabricación de acero.
- Se usa en la joyería, pues el diamante se considera una piedra preciosa de mucho valor.
- Se usa para filtrar y purificar agua, ya que forma parte del carbón activado, que es un material muy utilizado en sistemas de filtración.
- Se utiliza para producir pastillas que en medicina sirven para absorber toxinas del sistema digestivo.
- El isótopo carbono-14 (14C) se utiliza para saber la edad de rocas y fósiles.
- Se usa para fabricar lápices, ya que el grafito mezclado con arcilla es el material de las puntas de los lápices.
Compuestos basados en carbono
Compuestos orgánicos
Los compuestos orgánicos son compuestos químicos que tienen su estructura principal formada por enlaces carbono-carbono y carbono-hidrógeno. Además, pueden contener oxígeno (O), azufre (S), fósforo (P) y nitrógeno (N). Por ejemplo:
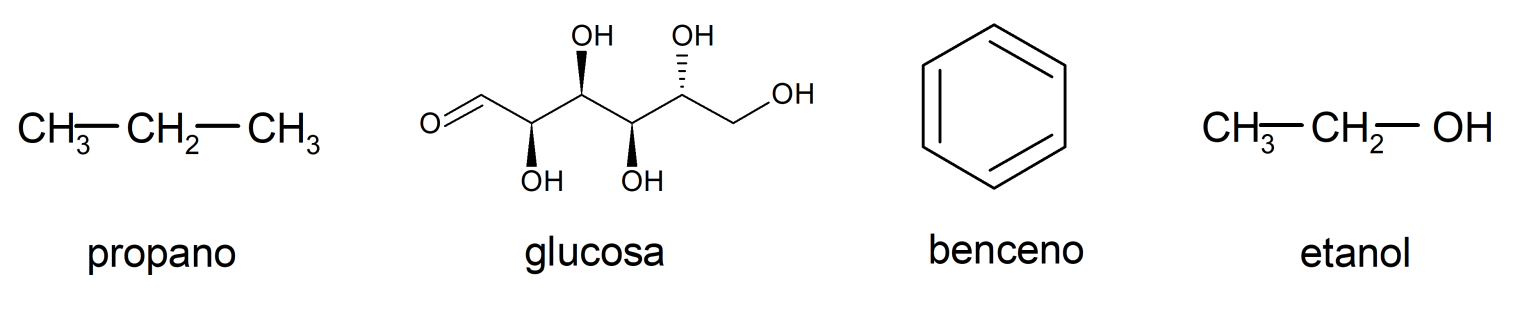
Compuestos inorgánicos
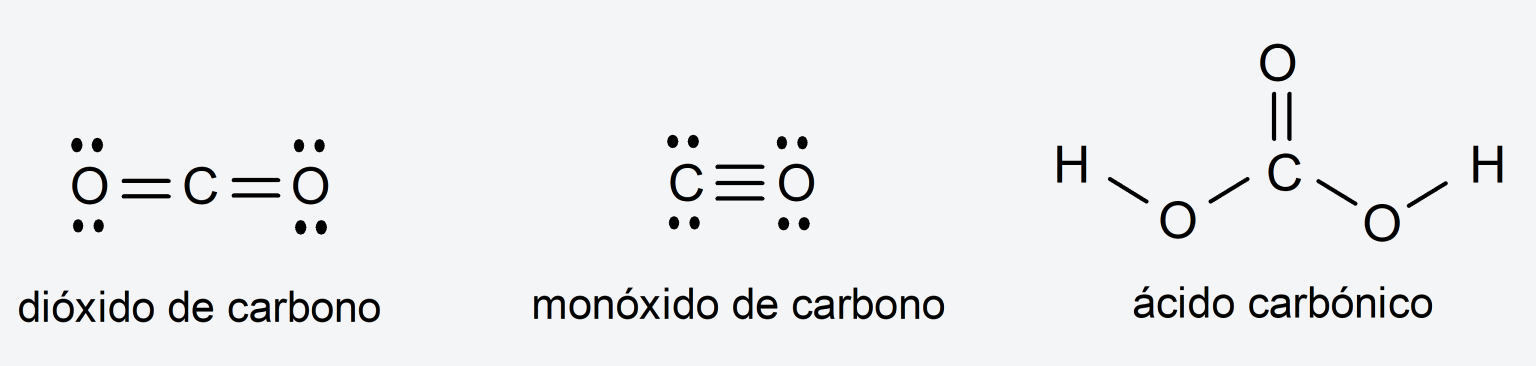
Los compuestos inorgánicos son compuestos químicos que están formados por diferentes elementos químicos, y no necesariamente contienen carbono.
Su estructura principal no está formada por carbono, pueden contener átomos de carbono formando parte de su estructura. Por ejemplo:
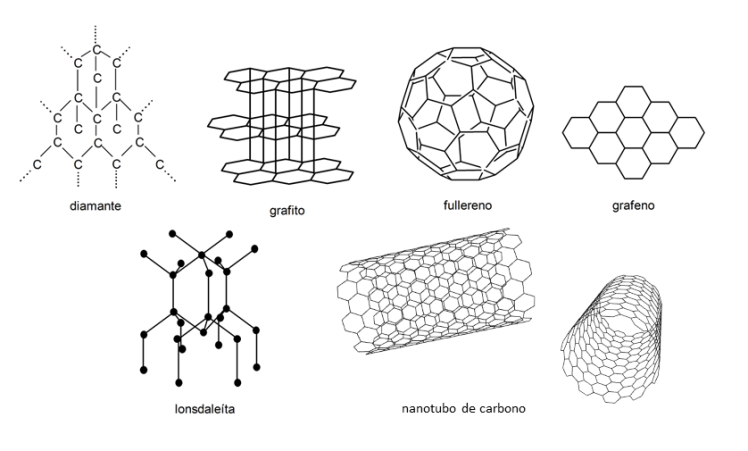
Alótropos del carbono

Los alótropos son las distintas sustancias simples (sustancias formadas por un solo elemento químico) que puede formar un elemento químico. En el caso del carbono, sus alótropos son las distintas sustancias simples que puede formar este elemento, dependiendo de cómo se enlazan sus átomos. Así, cada alótropo tiene distinta estructura molecular.
Cada alótropo de un mismo elemento puede variar en algunas propiedades, como su dureza, color, olor, punto de fusión (temperatura a la que un sólido se transforma en líquido), punto de ebullición (temperatura a la que la presión de un líquido se iguala a la presión de vapor de este líquido, entonces se transforma en vapor), entre otras.
Los principales alótropos del carbono son:
- El diamante. Tiene estructura cristalina cúbica centrada en las caras. Es muy duro, no conduce la electricidad y conduce muy bien el calor. Se le ha dado un gran valor comercial. Se utiliza en diversos tipos de industrias para cortar, perforar y pulir piezas. Además, se emplea en joyería: las joyas de diamantes son unas de las más caras del mundo.
- El grafito. Tiene estructura polimórfica y está formado por láminas de carbono llamadas “grafeno”. Es relativamente blando y conduce la electricidad. Se utiliza en el mecanismo de algunas lámparas, como lubricante en seco, como moderador en reactores nucleares y para fabricar lápices.
- Los fullerenos. Tienen estructura en forma esférica compuesta por hexágonos. Son insolubles en muchos disolventes. Se han utilizado en medicina para atacar bacterias y células cancerígenas.
- El grafeno. Tiene estructura plana regular y hexagonal. Es muy resistente, flexible y ligero. Se utiliza para fabricar blindajes antibalas y para protección contra la radiación ionizante.
- Los nanotubos de carbono. Tienen estructura en forma de cilindro hueco que se pueden ver como láminas de grafeno enrolladas. Cuando los nanotubos son simples, son muy rígidos y fuertes. Se utilizan en electrónica, óptica y nanotecnología.
- La lonsdaleíta. Tiene estructura hexagonal con forma similar al diamante, aunque es polimórfica. Es de color negro brillante. Fue encontrada en meteoritos.
Isótopos del carbono
Los isótopos son átomos de un mismo elemento químico que tienen en su núcleo el mismo número de protones, pero distinto número de neutrones.
Los principales isótopos del carbono son:
- Carbono-12 (12C). Está formado por 6 protones, 6 neutrones y 6 electrones. Es el isótopo del carbono que existe en mayor cantidad en la Tierra. Se utiliza como patrón para el cálculo de masas atómicas.
- Carbono-13 (13C). Está formado por 6 protones, 7 neutrones y 6 electrones. Se utiliza para evaluar la calidad de los suelos.
- Carbono-14 (14C). Está formado por 6 protones, 8 neutrones y 6 electrones. Se utiliza en arqueología para averiguar la edad de los fósiles.
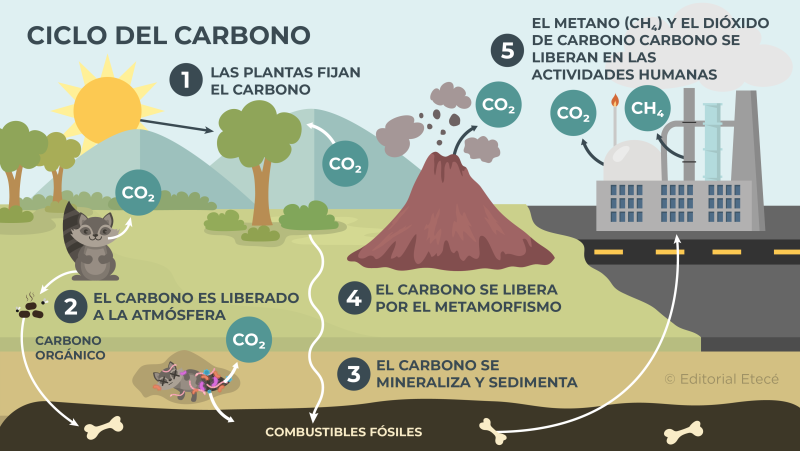
Ciclo del carbono
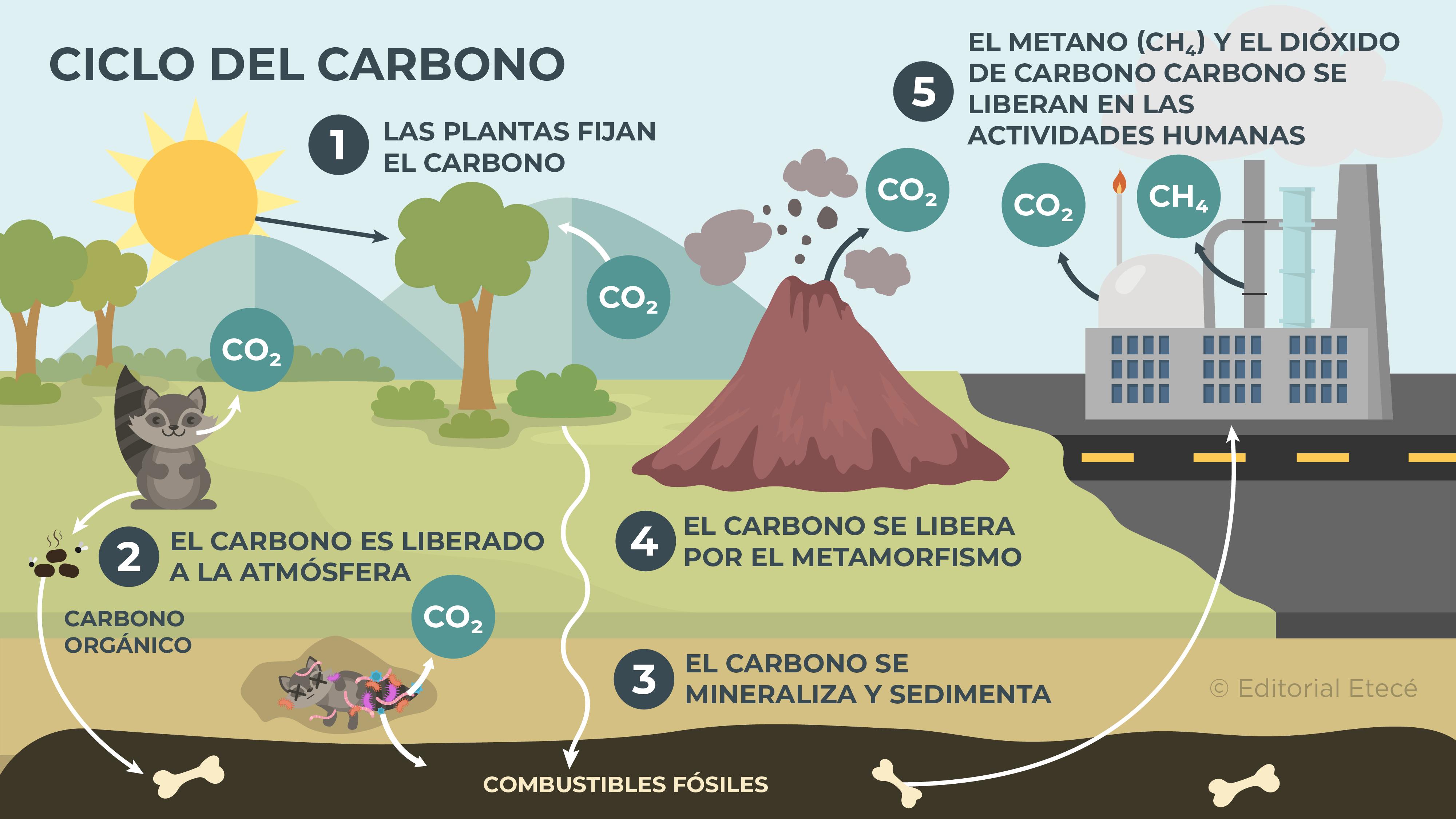
El ciclo del carbono es el proceso de circulación del carbono en el planeta Tierra. Durante este ciclo el carbono se traslada entre los distintos ecosistemas y el entorno que los rodea, y puede formar parte de distintos compuestos químicos que pueden existir en distintos estados de agregación (sólido, líquido, gas).
El ciclo del carbono está compuesto por diferentes etapas:
Etapa rápida o biológica
La etapa rápida es aquella en la que intervienen los procesos biológicos de los organismos vivos. Está formada por procesos como:
- Fijación del carbono por las plantas. Las plantas captan el dióxido de carbono (CO2) cuando realizan la fotosíntesis, de esta manera fijan el carbono.
- Liberación del carbono a la atmósfera. Cuando ocurre la respiración de los seres vivos y la descomposición de materia orgánica, se libera dióxido de carbono a la atmósfera.
Etapa lenta o geológica
La etapa lenta es aquella formada por procesos químicos y físicos que conducen al intercambio de carbono entre las distintas capas de la Tierra. Está formada por procesos como:
- Mineralización y sedimentación del carbono. El carbono se acumula y sedimenta, y puede formar fósiles y combustibles fósiles.
- Liberación del carbono debido al metamorfismo. El carbono está presente en algunas rocas, que cuando se mueven, lo liberan. Además, en la erupción de los volcanes se libera carbono.
- Liberación de dióxido de carbono (CO2) y metano (CH4) en las actividades humanas. El carbono se libera a la atmósfera como parte del CO2 y el CH4 que se emite en las actividades mineras e industriales que realiza el ser humano.
Sigue con:
Referencias
- Jaramillo, V. J. (2004). El ciclo global del carbono. Cambio climático: una visión desde México, 77(1), 77-85.
- CARNE, E. (2014). Química orgánica.
- McMurry, J., Mondragón, C. H., & Pozo, V. G. (2008).Química orgánica (pp. 560-574). México: Cengage learning.
- Chang, R. (2011). Fundamentos de química. Mexico-McGraw-Hill.




¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)