Conoce qué es el nitrógeno, sus características y propiedades. Además, sabrás dónde se encuentra, su importancia, usos e historia.

¿Qué es el nitrógeno?
El nitrógeno es un elemento químico de la Tabla Periódica que se representa con el símbolo N. Tiene número atómico 7 y masa atómica 14.007 uma. Es un no metal y a presión y temperatura normal (1 atm y 20 °C) existe como dinitrógeno (N2), un gas molecular.
Este elemento químico está presente en los seres vivos, ya que forma parte de las proteínas, del ácido desoxirribonucleico (ADN), del ácido ribonucleico (ARN) y del adenosín trifosfato (ATP).
Por otra parte, el nitrógeno constituye el 78 % de la atmósfera terrestre, donde está presente en forma de nitrógeno molecular (N2), que es una molécula muy estable, por lo que es difícil que reaccione con otras moléculas para formar compuestos químicos. No obstante, el nitrógeno experimenta algunas reacciones químicas en la atmósfera.
Además, este elemento es muy utilizado para producir fertilizantes y forma parte de productos químicos muy utilizados a nivel industrial, como el amoníaco.
Ver además: Estructura del ADN
Propiedades del nitrógeno
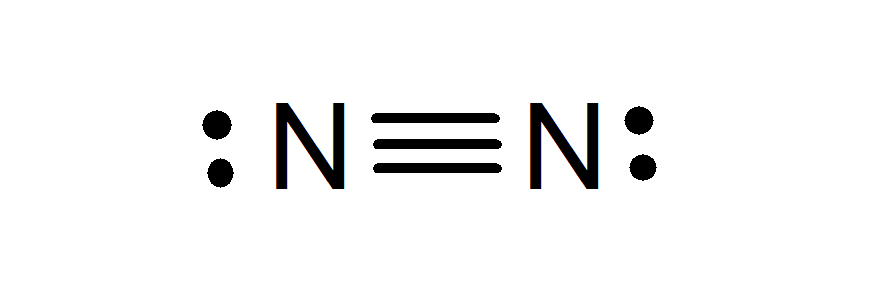
El nitrógeno en su forma molecular (N2) casi no experimenta reacciones químicas debido a que es muy estable. No obstante, experimenta algunas reacciones químicas, especialmente las relacionadas con la formación de amoníaco (NH3), un compuesto químico muy utilizado en la industria.
Propiedades físicas del nitrógeno
Algunas propiedades físicas del nitrógeno son:
- Es un gas incoloro, inodoro e insípido en condiciones normales de presión y temperatura.
- Es un no metal.
- No es un buen conductor del calor y la electricidad.
- Su punto de fusión es de -210 °C.
- Su punto de ebullición es de -196 °C.
Propiedades químicas del nitrógeno
Algunas propiedades químicas del nitrógeno son:
- Tiene estado de oxidación principal -3.
- Reacciona con litio en presencia de calor para formar nitruro de litio (Li3N), une compuesto químico que es el único nitruro estable formado con un metal alcalino (metales del Grupo I de la Tabla Periódica (litio, sodio, potasio, rubidio, cesio y francio)).

- Reacciona con dihidrógeno (H2) para formar amoníaco (NH3).

- Reacciona con oxígeno (O2) para formar distintos óxidos como monóxido de nitrógeno (NO). El NO a su vez, reacciona con O2 para formar dióxido de nitrógeno (NO2).
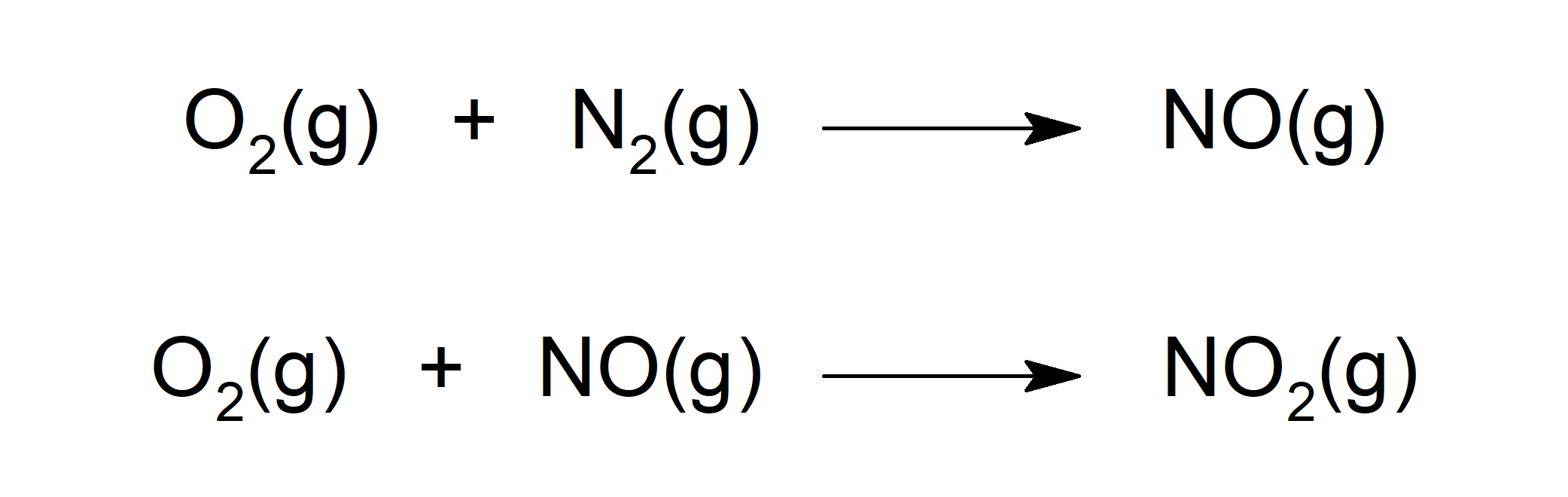
¿Para qué sirve el nitrógeno?

El nitrógeno tiene diversas aplicaciones en distintos procesos llevados a cabo por las personas. Uno de sus principales usos es como componente de partida en la producción de amoníaco (NH3). Además, se utiliza para inflar los neumáticos de los aviones, en la producción de acero inoxidable, en la extinción de incendios y en la fabricación de bombillas.
Por otra parte, existen muchos compuestos químicos que contienen nitrógeno que son ampliamente empleados por el hombre en distintas actividades, como por ejemplo:
- El nitrato de potasio (KNO3) se utiliza en la producción de pólvora.
- El amoníaco (NH3) y el nitrato de amonio (NH4NO3) se emplean en la producción de fertilizantes.
- La nitroglicerina (C3H5N3O9) y el trinitrotolueno (C7H5N3O6) se usan como explosivos.
- La hidracina (N2H4) se ha usado como parte de los combustibles para cohetes.
¿Dónde se encuentra el nitrógeno?
El nitrógeno constituye el 78 % de la atmósfera. Además, este elemento químico forma parte de los seres vivos ya que está presente en las proteínas: en el cuerpo humano ocupa el 3 % de la composición de elementos químicos.
Por otra parte, el nitrógeno está presente en productos de desecho de los seres vivos, como el guano, la urea y el ácido úrico. También se encuentra en forma de iones nitratos (NO3–), en la superficie terrestre y en las aguas del planeta.
Importancia biológica del nitrógeno
El nitrógeno es un elemento químico fundamental de la estructura de los aminoácidos, que son las moléculas que forman las proteínas y que constituyen una parte fundamental de los organismos vivos, por lo que influye en la formación y mantenimiento de los órganos y tejidos.
Además, este elemento participa en la formación de hormonas, anticuerpos y enzimas, forma parte del ADN y el ARN y juega un rol muy importante en el funcionamiento de la relajación muscular, del sistema nervioso central y el periférico. Este elemento químico también.
Efectos ambientales del nitrógeno
El nitrógeno ha sido muy utilizado en la producción de fertilizantes, que al ser esparcidos en los cultivos, han provocado un aumento de este elemento químico en los suelos y en las aguas del planeta.
Este exceso de nitrógeno en suelos y aguas ha provocado el proceso de eutrofización: un incremento excesivo de algas y microorganismos cuando tienen disponible un exceso de algún nutriente, como es el caso del nitrógeno. La sobrepoblación de estas algas y microorganismos hace que se consuma mucho oxígeno disuelto, lo que provoca la muerte de diversos organismos acuáticos.
Por otro lado, los óxidos de nitrógeno contribuyen a la formación de la lluvia ácida, y específicamente el óxido nitroso (N2O) es un potente gas de efecto invernadero. Además, los compuestos químicos con nitrógeno que se forman durante la combustión contribuyen a la contaminación atmosférica.
Ciclo del nitrógeno
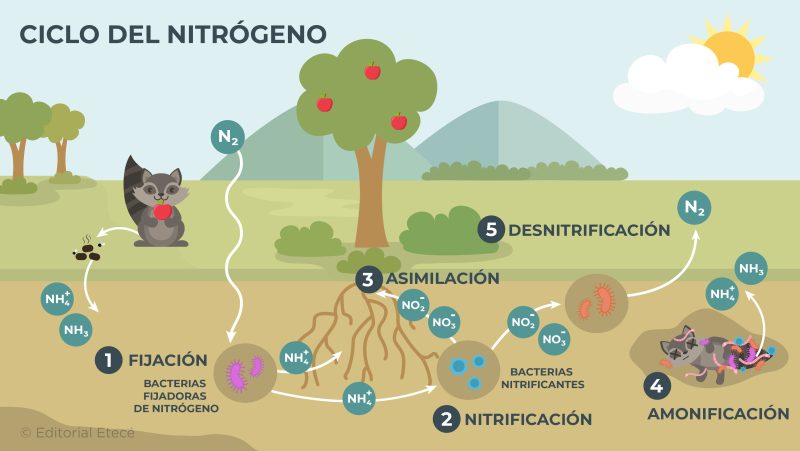
El ciclo del nitrógeno es la circulación de nitrógeno en el planeta Tierra. Mediante este ciclo, el nitrógeno se traslada entre los distintos ecosistemas y el ambiente que los rodea. Este ciclo está constituido por distintas etapas:
- Fijación. Es el proceso mediante el cual los organismos emplean el nitrógeno para ejecutar las reacciones químicas necesarias para que sus cuerpos funcionen correctamente. Los seres vivos utilizan compuestos químicos que contienen nitrógeno y que fueron formados por la acción de microorganismos o por la oxidación del nitrógeno atmosférico (N2).
- Nitrificación. Es el proceso mediante el cual el amoníaco (NH3) o el ion amonio (NH4+) se transforman en iones nitritos (NO2–) y nitratos (NO3–) por la acción de microorganismos específicos. Estos iones pueden ser incorporados a las plantas y los animales.
- Asimilación. Es el proceso mediante el cual las plantas y los animales incorporan el nitrógeno en sus organismos. Cuando estos organismos mueren y se descomponen, el nitrógeno nuevamente regresa al entorno que los rodea.
- Amonificación. Es el proceso mediante el cual el nitrógeno presente en los seres vivos es liberado al medio ambiente en forma de amoníaco (NH3) o ion amonio (NH4+). Ocurre durante la descomposición de organismos muertos o durante la excreción de desechos (orina y heces fecales) por parte de organismos vivos.
- Desnitrificación. Es el proceso mediante el cual microorganismos, como las bacterias desnitrificantes, descomponen los iones nitrato (NO3–) y nitrito (NO2–) en nitrógeno gaseoso (N2), que es liberado a la atmósfera.
Más en: Ciclo del nitrógeno
Historia del nitrógeno
Desde épocas muy antiguas se conocen algunos compuestos que contienen nitrógeno. Por ejemplo, los alquimistas conocían el ácido nítrico (HNO3), que llamaban aqua fortis (agua fuerte), y el agua regia (mezcla de ácido nítrico (HNO3) y ácido clorhídrico (HCl)), que era muy importante porque disuelve el oro.
No obstante, se considera que el nitrógeno fue descubierto en el año 1772 por el médico escocés Daniel Rutherford, quien lo nombró Aire Nocivo. Rutherford distinguió el nitrógeno del dióxido de carbono (CO2), y aunque no había identificado al nitrógeno como un elemento químico, sí observó que era un componente del aire que no experimentaba reacciones de combustión.
Por esos años, el nitrógeno también fue estudiado por el químico sueco Carl Wilhelm Scheele, el físico y químico francés Henry Cavendish y el científico británico Joseph Priestley, quien nombró a este elemento como aire quemado.
Por otro lado, el químico francés Antoine Lavoisier llamó al nitrógeno “aire mefítico” o “azote”, que significa sin vida, debido a que este elemento es muy inerte y casi no experimenta reacciones químicas. En el año 1790 el químico francés Jean-Antoine Chaptal introdujo la palabra nitrogène, de la cual se derivó en 1794 la palabra en inglés nitrogen.
Las primeras aplicaciones del nitrógeno se realizaron utilizando el nitrato de sodio (NaNO3) y el nitrato de potasio (KNO3) en aplicaciones industriales, agrícolas y militares, como la producción de pólvora.
Sigue con:
Referencias
- Mayz-Figueroa, J. (2004). Fijación biológica de nitrógeno. Revista Científica UDO Agrícola, 4(1), 1-20.
- Cárdenas-Navarro, R., Sánchez-Yáñez, J. M., Farías-Rodríguez, R., & Peña-Cabriales, J. J. (2004). Los aportes de nitrógeno en la agricultura. Revista Chapingo Serie Horticultura, 10(2), 173-178.
- Cerón Rincón, L. E., & Ancízar Aristizábal Gutiérrez, F. (2012). Dinámica del ciclo del nitrógeno y fósforo en suelos. Revista colombiana de Biotecnología, 14(1), 285-295.

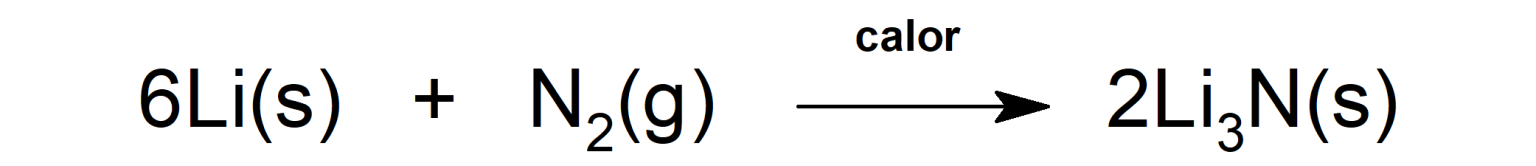
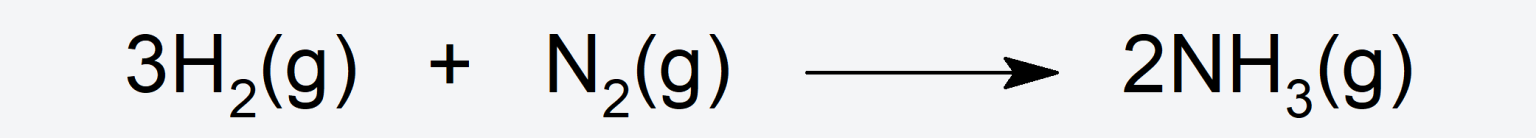






¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)