Te explicamos qué es y en qué consiste el modelo atómico de Lewis y sus características. Además, cuáles fueron sus errores y su importancia.
¿Qué es el modelo atómico de Lewis?
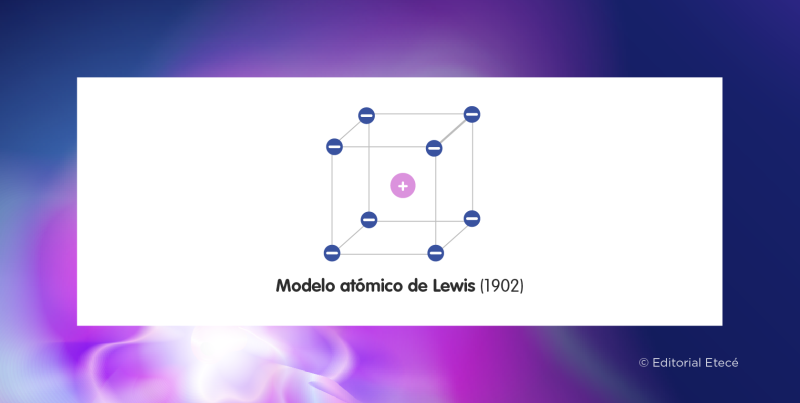
El modelo atómico de Lewis es uno de los modelos atómicos que intenta explicar la estructura del átomo. Fue propuesto por el fisicoquímico estadounidense Gilbert Newton Lewis en el año 1902. Este modelo también se conoce como “modelo del átomo cúbico”.
Según el modelo atómico de Lewis, los electrones de un átomo están ubicados en los ocho vértices de un cubo, es decir, el átomo está representado por un cubo con los electrones situados en sus vértices. Las ideas propuestas en este modelo están basadas en la Regla de Abegg, que establece que la diferencia entre el máximo y el mínimo número de oxidación de un elemento químico comúnmente es ocho.
Las ideas planteadas en este modelo fueron publicadas en 1916 en el artículo The Atom and the Molecule (El átomo y la molécula), y además, a través de ellas se intenta explicar la valencia, que es el número de electrones que cede o acepta un átomo para completar con ocho electrones su último nivel de energía.
Aunque fue desplazado por otros modelos atómicos, como el modelo atómico de Schrödinger, el modelo atómico de Lewis tuvo gran importancia científica para entender el enlace químico. Lewis además planteó la Regla del Octeto, la formación de pares de electrones en el enlace covalente y la Estructura de Lewis, que es una representación gráfica de átomos y moléculas, donde los electrones son representados por puntos y los pares de electrones que forman un enlace químico son representados por guiones.
- Ver además: Modelos atómicos
Características del modelo atómico de Lewis
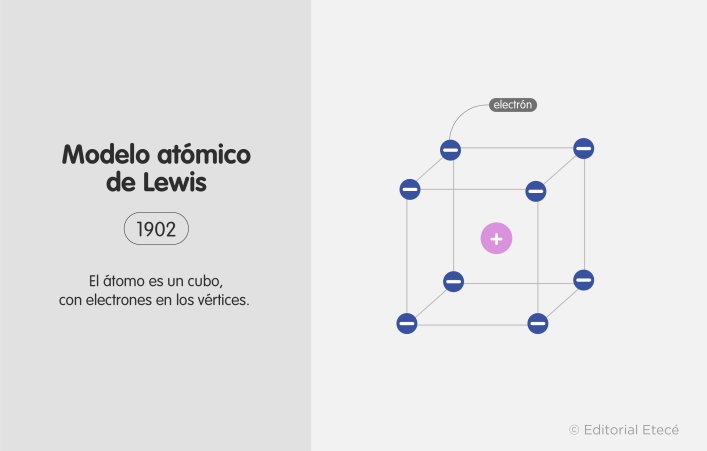
El modelo atómico de Lewis marcó un paso importante en la descripción del enlace químico. Algunas de las características principales de este modelo atómico son:
- Representa a los electrones de un átomo en los ocho vértices de un cubo. Según esta representación se encontró una forma de describir el enlace covalente.
- Se basa en la Regla del Octeto. Esta regla plantea que los iones de los elementos químicos de la Tabla Periódica tienden a completar sus últimos niveles de energía con 8 electrones y, de esta forma, adquieren una configuración muy estable. Así, los átomos se enlazan entre sí para completar sus últimos niveles de energía con 8 electrones.
- Describe una manera de explicar la formación de los distintos enlaces químicos. Explica la formación de los distintos enlaces químicos, como el enlace iónico, covalente simple, doble y triple.
- Describe la organización de los electrones cuando forman un enlace químico. Introduce la idea de que los electrones se ubican formando pares cuando forman los enlaces químicos que unen los átomos en la formación de compuestos moleculares.
- Justifica la existencia de distintas formas moleculares. La forma molecular depende de la disposición de los pares de electrones.
Enlaces químicos según el modelo atómico de Lewis
El modelo atómico de Lewis tuvo un gran impacto en la descripción del enlace químico. En el modelo se propone una explicación para la formación del enlace covalente y el enlace iónico.
Según Lewis, algunos tipos de enlaces se forman de la siguiente manera:
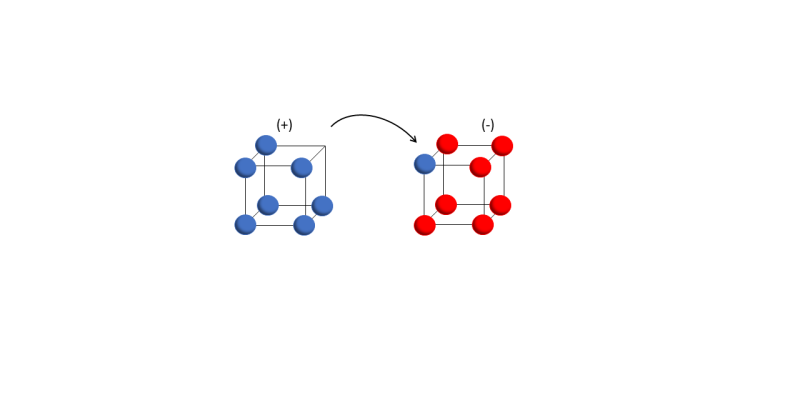
- Enlace iónico. Se forma cuando se transfiere un electrón de un cubo a otro y no se comparte ninguna arista del cubo.
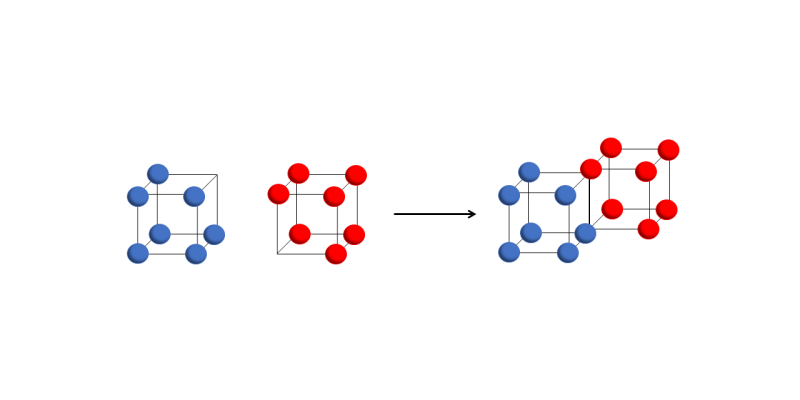
- Enlace covalente simple. Se forma cuando dos cubos comparten un borde, lo que implica que se comparten dos electrones.
- Enlace covalente doble. Se forma cuando dos cubos comparten una cara, lo que implica que se comparten cuatro electrones.
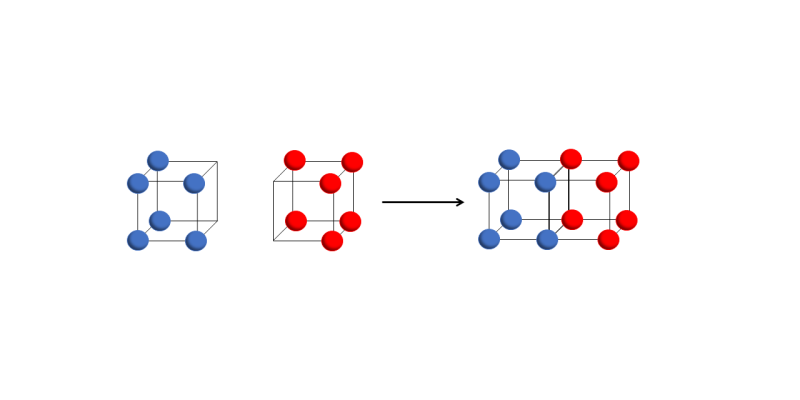
Enlace covalente triple
Los enlaces covalentes triples no podían ser explicados utilizando el modelo del átomo cúbico, pues en un enlace covalente triple se comparten seis electrones. Según este modelo, en cada vértice del cubo está ubicado un electrón y no es posible que dos cubos compartan los electrones ubicados en seis vértices, por lo que no se puede explicar la formación de este tipo de enlace.
No obstante, para poder explicar el enlace covalente triple, Lewis propuso una reubicación de los electrones en el cubo: en vez de estar ubicados en los vértices del cubo, los electrones están ubicados en el centro de cada lado.
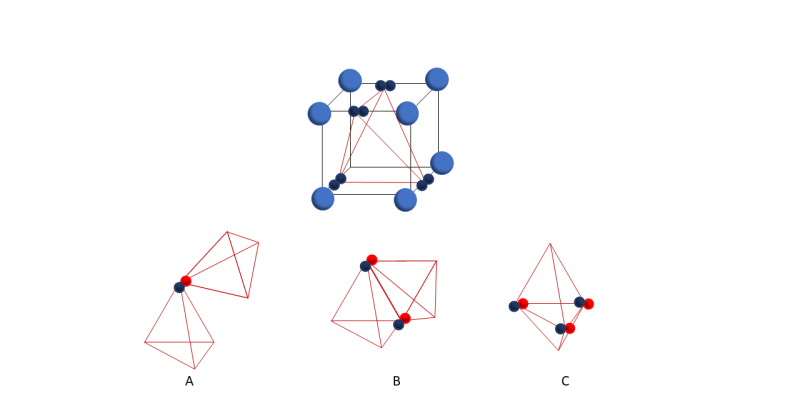
Utilizando esta nueva idea, un enlace simple se explica por la compartición de una esquina (Figura A), un enlace doble por la compartición de un lado (Figura B), y un enlace triple por la compartición de una cara (Figura C).
Esta nueva idea se puede interpretar como una nueva geometría en la que los pares de electrones están ubicados en los vértices de un tetraedro, y en un tetraedro sí es posible compartir los seis electrones que forman un triple enlace. Además, esta geometría puede explicar la geometría tetraédrica del metano (CH4), que ya se conocía, pero no se podía explicar con detalles.
- Ver también: Enlace covalente
Errores del modelo atómico de Lewis
Si bien el modelo atómico de Lewis era consistente y útil para explicar la formación de los enlaces covalentes simples y dobles, no era adecuado para explicar la formación de los enlaces covalentes triples, por lo que debió ser modificado. Además, Lewis también cometió errores para explicar la estabilidad de los sistemas atómicos.
Importancia del modelo atómico de Lewis
Algunas de las contribuciones de este modelo para el conocimiento de la estructura del átomo fueron:
- Descripción del enlace químico. Estableció un marco práctico para describir y entender el enlace químico.
- Electrones pareados en la estructura molecular. Introdujo la idea de electrones pareados en la descripción de la estructura molecular.
- Base para la TRPECV. Sirvió de base para proponer la Teoría de Repulsión de Pares de Electrones de la Capa de Valencia (TRPECV).
- Repulsión entre pares de electrones. La TRPECV plantea que los pares de electrones en la capa de valencia de un átomo se repelen entre sí y adoptan una disposición que minimiza esta repulsión.
- Determinación de la forma molecular. La disposición espacial de los pares de electrones determina la forma que tendrá la molécula.
Sigue con:
Referencias
- Lewis, G. N. (1916) The Atom and the Molecule. J. Am. Chem. Soc. 762-785.
- Halliday, David. (2007). Fundamentals of Physics. 8vª edición, Wiley. ISBN 0-471-15950-6.
- Gispert, Jaime Casabó (1996). Estructura atómica y enlace químico. Reverte. ISBN 9788429171891.





¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)