Te explicamos qué es el número atómico y su relación con la masa atómica. Además, el número atómico de cada elemento químico.
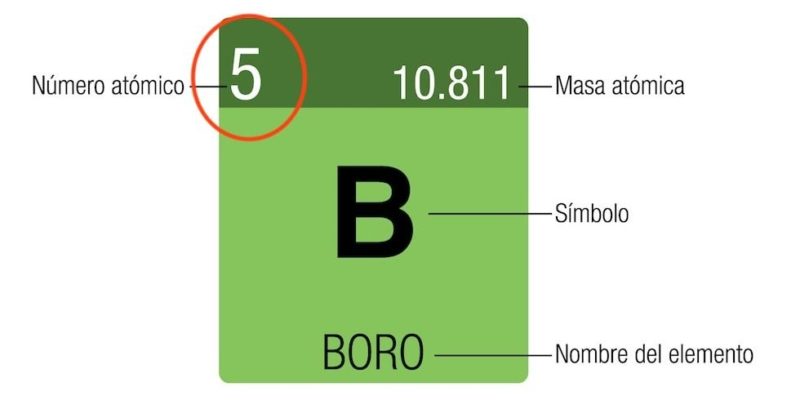
¿Qué es el número atómico?
Tanto en física como en química, el número atómico es el número total de protones que componen el núcleo atómico de un elemento químico determinado.
Suele denotarse con la letra Z (proveniente de la palabra alemana zahl, “número”) y colocarse como subíndice a la izquierda del símbolo químico del elemento en cuestión, justo debajo del número másico A (cantidad de nucleones en el núcleo, es decir, suma del número de protones y el número de neutrones). Por ejemplo:
2311Na (elemento: sodio, número atómico: 11, y número másico: 23)
Todos los átomos están compuestos de partículas subatómicas: algunas forman parte de su núcleo (protones y neutrones) y otras giran a su alrededor (electrones). Los protones tienen carga positiva, los neutrones tienen carga neutra y los electrones tienen carga negativa (electrones).
Dado que los átomos en la naturaleza son eléctricamente neutros, la cantidad de partículas positivas y negativas es la misma, de modo que si un átomo tiene Z = 11, tendrá once protones y once electrones alrededor.
Además, el número atómico permite organizar los elementos conocidos en la Tabla Periódica, van del menor al mayor número de protones en el núcleo a medida que se avanza por las filas y columnas de la tabla. Por ejemplo, el hidrógeno (H) tiene apenas un protón (Z = 1), mientras que el oganesón (Og) posee ciento dieciocho (Z = 118). Así se puede diferenciar elementos livianos de elementos pesados.
Ver además: Modelos atómicos
Ejemplos de número atómico
Estos son los números atómicos de la Tabla Periódica completa:
| Hidrógeno (H): Z = 1 | Helio (He): Z = 2 |
| Litio (Li): Z = 3 | Berilio (Be): Z = 4 |
| Boro (B): Z = 5 | Carbono (C): Z = 6 |
| Nitrógeno (N): Z = 7 | Oxígeno (O): Z = 8 |
| Flúor (F): Z = 9 | Neón (Ne): Z = 10 |
| Sodio (Na): Z = 11 | Magnesio (Mg): Z = 12 |
| Aluminio (Al): Z = 13 | Silicio (Si): Z = 14 |
| Fósforo (P): Z = 15 | Azufre (S): Z = 16 |
| Cloro (Cl): Z = 17 | Argón (Ar): Z = 18 |
| Potasio (K): Z = 19 | Calcio (Ca): Z = 20 |
| Escandio (Sc): Z = 21 | Titanio (Ti): Z = 22 |
| Vanadio (V): Z = 23 | Cromo (Cr): Z = 24 |
| Manganeso (Mn): Z = 25 | Hierro (Fe): Z = 26 |
| Cobalto (Co): Z = 27 | Níquel (Ni): Z = 28 |
| Cobre (Cu): Z = 29 | Zinc (Zn): Z = 30 |
| Galio (Ga): Z = 31 | Germanio (Ge): Z = 32 |
| Arsénico (As): Z = 33 | Selenio (Se): Z = 34 |
| Bromo (Br): Z = 35 | Kriptón (Kr): Z = 36 |
| Rubidio (Rb): Z = 37 | Estroncio (Sr): Z = 38 |
| Itrio (Y): Z = 39 | Zirconio (Zr): Z = 40 |
| Niobio (Ni): Z = 41 | Molibdeno (Mb): Z = 42 |
| Tecnecio (Tc): Z = 43 | Rutenio (Ru): Z = 44 |
| Rodio (Rh): Z = 45 | Paladio (Pd): Z = 46 |
| Plata (Ag): Z = 47 | Cadmio (Cd): Z = 48 |
| Indio (In): Z = 49 | Estaño (Sn): Z = 50 |
| Antimonio (Sb): Z = 51 | Telurio (Te): Z = 52 |
| Yodo (I): Z = 53 | Xenón (Xe): Z = 54 |
| Cesio (Cs): Z = 55 | Bario (Ba): Z = 56 |
| Lantano (La): Z = 57 | Cerio (Ce): Z = 58 |
| Praseodimio (Pr): Z = 59 | Neodimio (Nd): Z = 60 |
| Prometio (Pr): Z = 61 | Samario (Sm): Z = 62 |
| Europio (Eu): Z = 63 | Gadolinio (Gd): Z = 64 |
| Terbio (Tb): Z = 65 | Disprosio (Dy): Z = 66 |
| Holmio (Ho): Z = 67 | Erbio (Er): Z = 68 |
| Tulio (Tm): Z = 69 | Iterbio (Yb): Z = 70 |
| Lutecio (Lu): Z = 71 | Hafnio (Hf): Z = 72 |
| Tantalio (Ta): Z = 73 | Wolframio (W): Z = 74 |
| Renio (Re): Z = 75 | Osmio (Os): Z = 76 |
| Iridio (Ir): Z = 77 | Platino (Pt): Z = 78 |
| Oro (Au): Z = 79 | Mercurio (Hg): Z = 80 |
| Talio (Tl): Z = 81 | Plomo (Pb): Z = 82 |
| Bismuto (Bi): Z = 83 | Polonio (Po): Z = 84 |
| Ástato (At): Z = 85 | Radón (Rn): Z = 86 |
| Francio (Fr): Z = 87 | Radio (Ra): Z = 88 |
| Actinio (Ac): Z = 89 | Torio (Th): Z = 90 |
| Proactinio (Pa): Z = 91 | Uranio (U): Z = 92 |
| Neptunio (Np): Z = 93 | Plutonio (Pu): Z = 94 |
| Americio (Am): Z = 95 | Curio (Cm): Z = 96 |
| Berkelio (Bk): Z = 97 | Californio (Cf): Z = 98 |
| Einstenio (Es): Z = 99 | Fermio (Fm): Z = 100 |
| Mendelevio (Md): Z = 101 | Nobelio (No): Z = 102 |
| Laurencio (Lr): Z = 103 | Rutherfordio (Rf): Z = 104 |
| Dubnio (Db): Z = 105 | Seaborgio (Sg): Z = 106 |
| Bohrio (Bh): Z = 107 | Hasio (Hs): Z = 108 |
| Meitnerio (Mt): Z = 109 | Darmstatio (Ds): Z = 110 |
| Roentgenio (Rg): Z = 111 | Copernicio (Cn): Z = 112 |
| Nihomio (Nh): Z = 113 | Flerovio (Fl): Z = 114 |
| Moscovio (Mc): Z = 115 | Livermorio (Lv): Z = 116 |
| Teneso (Ts): Z = 117 | Oganesón (Og): Z = 118 |
Número másico y masa atómica
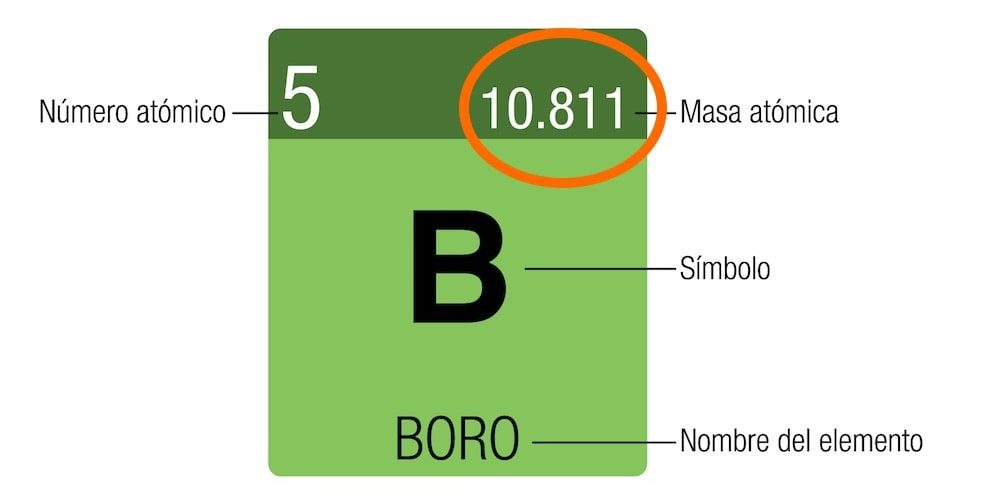
El número másico es la suma de los protones y los neutrones. Se denota con la letra A (del alemán Atomgewicht) como superíndice a la izquierda del símbolo químico (por ejemplo: 23Na).
El número másico suele ser aproximadamente el doble que el número atómico ya que los neutrones brindan estabilidad al núcleo atómico, y superan así la natural repulsión entre protones de carga positiva. A diferencia del número atómico, el número másico varía en cada isótopo.
El número másico puede calcularse según la fórmula:
Número másico (A) = número atómico (Z) + número de neutrones (N)
No debe confundirse el número másico con la masa atómica. La masa atómica se mide en unidades u.m.a (unidad de masa atómica) o Da (dalton). Esta unidad se calcula a partir del átomo de carbono y cada u.m.a es una doceava parte de su masa. En la tabla periódica figura la masa atómica del isótopo más estable.
Sigue con:
Referencias
- “Número atómico, número másico e isótopos” en https://es.khanacademy.org/
- “¿Qué es el número atómico?” en https://clickmica.fundaciondescubre.es/
- “Understanding Atomic Number and Atomic Mass” (video) en https://www.youtube.com/
- “Atomic number” en https://www.britannica.com/




¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)