Te explicamos la evolución del modelo atómico y cuáles son los modelos atómicos que la conforman. Además, una línea del tiempo de su historia.

Historia de la evolución del modelo atómico
El modelo atómico es una representación e interpretación de la estructura y composición del átomo. Utilizando el modelo atómico podemos estudiar el comportamiento y las propiedades de los átomos, y explicar la formación de los compuestos químicos.
Desde tiempos remotos, surgió la idea de que la materia está formada por pequeñas unidades discretas llamadas átomos. Las primeras ideas sobre la composición atómica de la materia surgieron en la antigua Grecia y en la India. Estas ideas estaban argumentadas utilizando el razonamiento filosófico y teológico, y no la observación y la experimentación, por lo que inicialmente no fueron aceptadas por los estudiosos de la época.
No obstante, con el pasar de los años la idea de un universo compuesto por átomos fue desarrollándose, lo que dio lugar al surgimiento de los modelos atómicos, que con el avance de los estudios y la tecnología cada vez más se han ido acercando al átomo real.
Para comprender cómo ocurrió la transición de un modelo atómico hacia otro, conviene hacer un recorrido por los modelos atómicos más importantes, desde el modelo de Demócrito en el 460 a. C., pasando por el modelo de Schrödinger, en 1926, hasta llegar al modelo atómico actual. De esta manera, se pueden observar las contribuciones de cada modelo a la descripción más real de la estructura del átomo.
- Ver además: Modelos atómicos
1. Modelo atómico de Demócrito (460 a. C.)
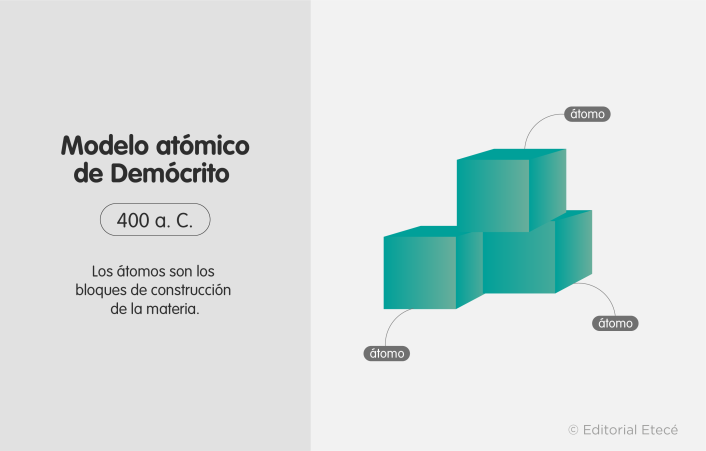
El modelo atómico de Demócrito fue propuesto por Demócrito de Abdera (filósofo y polímata griego).
Plantea que los átomos son eternos, indivisibles, homogéneos, indestructibles, e invisibles. Además, son los bloques de construcción del universo y se diferencian en forma y tamaño, pero no tienen estructura interna.
- Más en: Modelo atómico de Demócrito
2. Modelo atómico de Dalton (1803-1808)

El modelo atómico de Dalton fue propuesto por John Dalton (químico, matemático y meteorólogo inglés).
En la teoría atómica de Dalton, este modelo plantea que el átomo es una unidad indivisible, con alguna forma esférica.
Además, los átomos de un mismo elemento son iguales, tienen la misma masa y las mismas propiedades. Por otra parte, establece que los átomos no se pueden dividir y cuando se combinan átomos para formar un compuesto químico, estos se combinan en proporciones simples.
- Más en: Modelo atómico de Dalton
3. Modelo atómico de Thomson (1898)

El modelo atómico de Thomson fue propuesto por Joseph John Thomson (ingeniero y matemático inglés).
Plantea que los átomos están formados por una región esférica positiva con los electrones incrustados en ella.
Esta disposición de los electrones es similar a la distribución de las pasas en un budín, por eso se le conoce como el modelo del budín con pasas.
- Más en: Modelo atómico de Thomson
4. Modelo atómico de Lewis (1902)
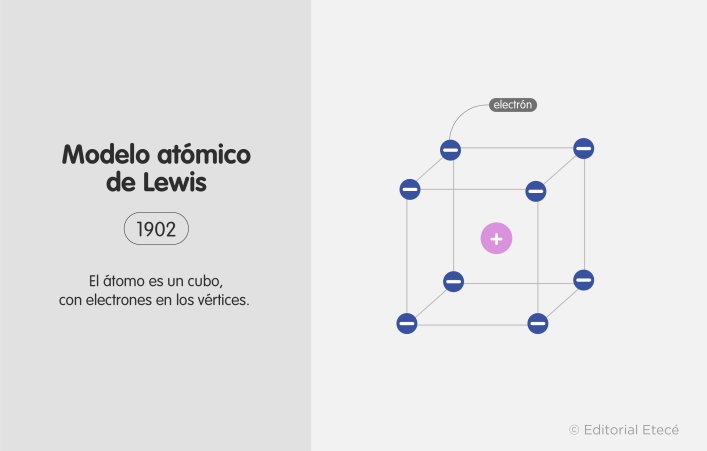
El modelo atómico de Lewis fue propuesto por Gilbert N. Lewis (fisicoquímico estadounidense).
Plantea que el átomo es un cubo con los electrones ubicados en sus vértices. Este modelo fue fundamental en la descripción y explicación del enlace químico.
- Más en: Modelo atómico de Lewis
5. Modelo atómico de Rutherford (1911)
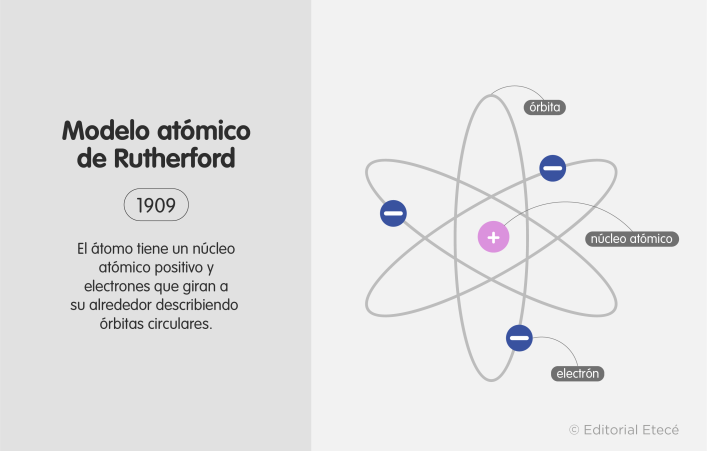
El modelo atómico de Rutherford fue propuesto por Ernest Rutherford (físico neozelandés).
Plantea que el átomo tiene un núcleo donde se concentra la carga positiva, y alrededor de él orbitan los electrones. Este modelo propone la existencia de un núcleo atómico.
- Más en: Modelo atómico de Rutherford
6. Modelo atómico de Bohr (1913)
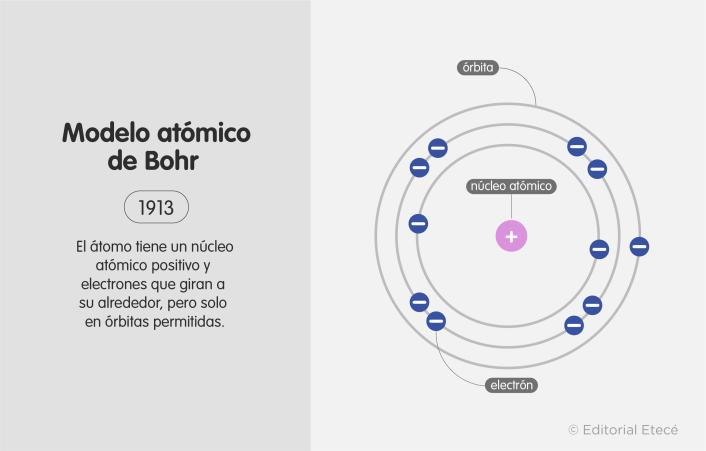
El modelo atómico de Bohr fue propuesto por Niels Bohr (físico danés).
Plantea que los electrones giran alrededor del núcleo atómico siguiendo trayectorias específicas sin perder energía. Además, los electrones solo emiten o absorben energía cuando saltan entre órbitas permitidas.
- Más en: Modelo atómico de Bohr
7. Modelo atómico de Sommerfeld (1916)
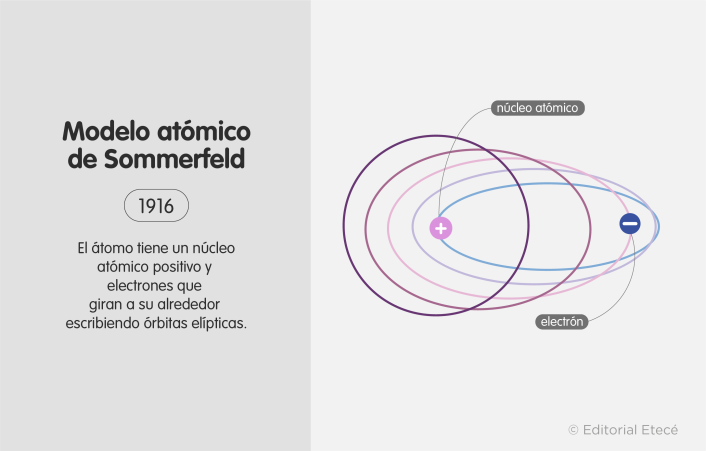
El modelo atómico de Sommerfeld fue propuesto por Arnold Sommerfeld (físico alemán).
Este modelo mejoró el modelo de Bohr, pues establece que los electrones se mueven en órbitas elípticas (no esféricas, como sugirió Bohr) alrededor del núcleo y que además existen subniveles de energía en un mismo nivel de energía.
- Más en: Modelo atómico de Sommerfeld
8. Modelo atómico de Schrödinger (1926)

El modelo atómico de Schrödinger fue propuesto por Erwin Schrödinger (físico y filósofo austríaco).
Establece la idea del comportamiento de los electrones como ondas de materia con dualidad onda-partícula. Este modelo se conoce como modelo de nube electrónica.
- Más en: Modelo atómico de Schrödinger
Modelo atómico actual
El modelo atómico que se utiliza en la actualidad, conocido como modelo mecanocuántico, está basado en la mecánica cuántica, y toma los aportes de Schrödinger, Pauli y Einstein, entre otros científicos. Este modelo surgió de la evolución de modelos anteriores como el modelo de Rutherford, el de Bohr y el de Sommerfeld.
En este modelo el átomo se representa como nubes de electrones alrededor del núcleo. Es decir, no se representa más el átomo como un núcleo con electrones girando a su alrededor, como se representaba en modelos atómicos anteriores.
Además, se aplican ciertas reglas, como el principio de exclusión de Pauli, que plantea que no pueden existir dos fermiones, en este caso electrones, con todos los números cuánticos iguales. Por otra parte, se utiliza el espín, que es una propiedad de las partículas elementales relacionada con su momento angular intrínseco.
En el modelo atómico actual, los electrones tienen comportamiento tanto ondulatorio como corpuscular, es decir, se comportan como ondas y como partículas. A esto se le llama dualidad onda-partícula.
Por otro lado, se utiliza la ecuación de Schrödinger para calcular los valores de energía y de momento angular permitidos, así como la función de onda, que cuando se eleva al cuadrado representa la probabilidad de encontrar a un electrón en el espacio.
Ĥψ(r) = Eψ(r)
Ecuación de Schrödinger independiente del tiempo
donde:
- ψ(r) es la función de onda independiente del tiempo.
- Ĥ es el operador hamiltoniano y caracteriza la energía total de sistema.
- r son las coordenadas nucleares.
Sigue con:
Referencias
- Atkins Peter, de Paula Julio. (2020) Química Física. 8va Edición. Editorial Médica Panamericana. ISBN: 9789500696418
- Kramer, Kenneth (1988). Introductory nuclear physics. John Wiley & Sons Inc.ISBN. 047180553X
- Halliday, David. (2007). Fundamentals of Physics. 8va edición. Wiley. ISBN 0-471-15950-6.





¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)