Te explicamos qué son las leyes de la termodinámica y cuáles son, con sus características y ejemplos. Además, la historia de su origen y evolución.

¿Qué son las leyes de la termodinámica?
Las leyes de la termodinámica (o los principios de la termodinámica) describen el comportamiento de tres cantidades físicas fundamentales, la temperatura, la energía y la entropía, que caracterizan a los sistemas termodinámicos. Son cruciales para comprender las leyes físicas del universo y la imposibilidad de ciertos fenómenos como el del movimiento perpetuo.
Existen cuatro leyes de la termodinámica:
- Ley cero de la termodinámica
- Primera ley de la termodinámica
- Segunda ley de la termodinámica
- Tercera ley de la termodinámica
Matemáticamente, estos principios se describen mediante un conjunto de ecuaciones que explican el comportamiento de los sistemas termodinámicos, definidos como cualquier objeto de estudio (desde una molécula o un ser humano, hasta la atmósfera o el agua hirviendo en una cacerola).
El término «termodinámica» proviene del griego thermos, que significa “calor”, y dynamos, que significa “fuerza”.
Te puede interesar: Termodinámica
Ley “cero” de la termodinámica
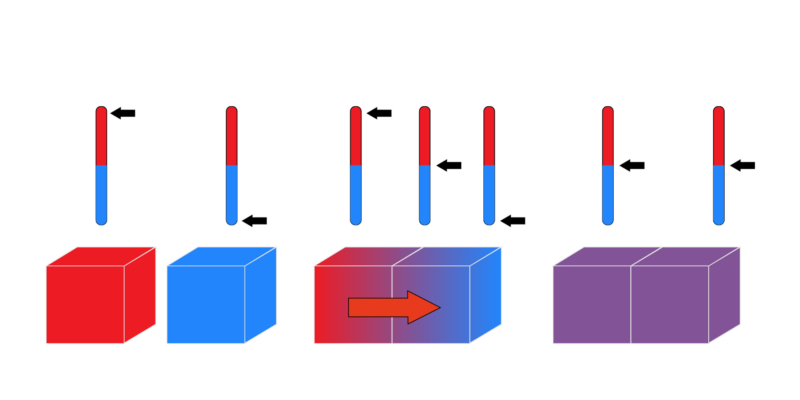
La “ley cero” se conoce con ese nombre aunque fue la última en postularse. También conocida como Ley del Equilibrio Térmico, este principio dicta que: “Si dos sistemas están en equilibrio térmico de forma independiente con un tercer sistema, deben estar también en equilibrio térmico entre sí”. Puede expresarse lógicamente del siguiente modo: si A = C y B = C, entonces A= B.
Esta ley nos permite comparar la energía térmica de tres cuerpos distintos A, B, y C. Si el cuerpo A se encuentra en equilibrio térmico con el cuerpo C (tienen la misma temperatura) y B también tiene la misma temperatura que C, entonces A y B poseen igual temperatura.
Otra forma de enunciar este principio es argumentar que al poner en contacto dos cuerpos con distintas temperaturas, intercambian calor hasta que sus temperaturas se igualan.
Los ejemplos cotidianos de esta ley son fáciles de hallar. Cuando nos metemos en agua fría o caliente, notaremos la diferencia de temperatura solo durante los primeros minutos ya que nuestro cuerpo luego entrará en equilibrio térmico con el agua y no notaremos más la diferencia. Lo mismo ocurre cuando entramos a una habitación calurosa o fría: notaremos la temperatura al principio, pero luego dejaremos de percibir la diferencia pues entraremos en equilibrio térmico con ella.
Ver además: Equilibrio térmico
Primera ley de la termodinámica

La primera ley se llama “Ley de la Conservación de la Energía” porque dicta que en cualquier sistema físico aislado de su entorno, la cantidad total de energía será siempre la misma, a pesar de que pueda transformarse de una forma de energía a otras diferentes. O dicho en otras palabras: la energía no puede crearse ni destruirse, solo transformarse.
De ese modo, al suministrar una cantidad determinada de calor (Q) a un sistema físico, su cantidad total de energía podrá calcularse como el calor suministrado menos el trabajo (W) efectuado por el sistema sobre sus alrededores. Expresado en una fórmula: ΔU = Q – W.
Como ejemplo de esta ley, imaginemos el motor de un avión. Se trata de un sistema termodinámico que consta de combustible que al reaccionar químicamente durante el proceso de combustión, libera calor y efectúa un trabajo (que hace que el avión se mueva). Entonces: si pudiéramos medir la cantidad de trabajo realizado y de calor liberado, podríamos calcular la energía total del sistema y concluir que la energía en el motor se mantuvo constante durante el vuelo: ni se creó ni se destruyó energía, sino que se la hizo cambiar de energía química a energía calórica y energía cinética (movimiento, o sea, trabajo).
Ver además: Principio de conservación de la energía
Segunda ley de la termodinámica
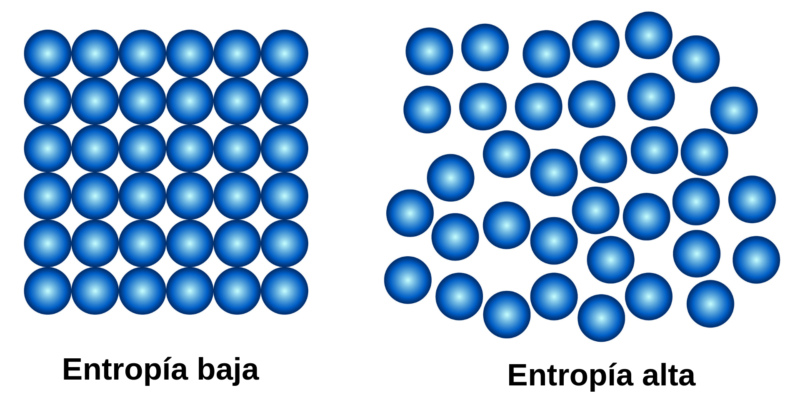
La segunda ley, también llamada «Ley de la Entropía», puede resumirse en que la cantidad de entropía en el universo tiende a incrementarse en el tiempo. Eso significa que el grado de desorden de los sistemas aumenta hasta alcanzar un punto de equilibrio, que es el estado de mayor desorden del sistema.
Esta ley introduce un concepto fundamental en física: el concepto de entropía (representada con la letra S), que en el caso de los sistemas físicos representa el grado de desorden. Resulta que en cada proceso físico en el que hay una transformación de energía, cierta cantidad de energía no es utilizable, es decir, no puede realizar trabajo. Si no puede realizar trabajo, en la mayoría de los casos esa energía es calor. Ese calor que libera el sistema, lo que hace es aumentar el desorden del sistema, su entropía. La entropía es una medida del desorden de un sistema.
La formulación de esta ley establece que el cambio en la entropía (dS) será siempre igual o mayor a la transferencia de calor (dQ), dividido por la temperatura (T) del sistema. O sea, que: dS ≥ dQ / T.
Para entender esto con un ejemplo, basta con quemar una cantidad determinada de materia y luego juntar las cenizas resultantes. Al pesarlas, comprobaremos que es menos materia que la que había en su estado inicial: parte de la materia se convirtió en calor en forma de gases que no pueden realizar un trabajo sobre el sistema y que contribuyen a su desorden.
Ver además: Transferencia de calor
Tercera ley de la termodinámica

La tercera ley plantea que la entropía de un sistema que sea llevado al cero absoluto, será una constante definida. Dicho en otras palabras:
- Al llegar al cero absoluto (cero en unidades de Kelvin), los procesos de los sistemas físicos se detienen.
- Al llegar al cero absoluto (cero en unidades de Kelvin ), la entropía posee un valor mínimo constante.
Resulta difícil alcanzar cotidianamente el llamado cero absoluto (-273,15 ° C), pero podemos pensar esta ley analizando lo que ocurre en un congelador: los alimentos que depositemos allí se enfriarán tanto, que se ralentizarán o incluso detendrán los procesos bioquímicos en su interior. Por eso se retarda su descomposición y será apto su consumo durante mucho más tiempo.
Ver también: Entropía
Historia de las leyes de la termodinámica
Los cuatro principios de la termodinámica poseen orígenes distintos, y algunos fueron formulados a partir de los anteriores. El primero en establecerse, de hecho, fue el segundo, obra del físico e ingeniero francés Nicolás Léonard Sadi Carnot en 1824.
Sin embargo, en 1860 este principio volvió a formularse por Rudolf Clausius y William Thompson, añadiendo entonces la que hoy llamamos la Primera Ley de la Termodinámica. Más adelante apareció la tercera, también conocida como «postulado de Nerst» porque surgió gracias a los estudios de Walther Nernst entre 1906 y 1912.
Finalmente, la llamada “ley cero” apareció en 1930, propuesta por Guggenheim y Fowler. Cabe decir que no en todos los ámbitos es reconocida como una verdadera ley.
Referencias
- “Leyes de la termodinámica” en Geofrik’s Blog.
- “Las leyes de la termodinámica” en Khan Academy.
- “Thermodynamics” en The Enciclopaedia Britannica.
- “Las leyes de la termodinámica en 5 minutos” (Video) en Quantum Fracture.
¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)