Te explicamos qué es el modelo atómico de Bohr, sus características y qué establecen sus postulados. Además, sabrás cuáles son sus limitaciones.

¿Qué es el modelo atómico de Bohr?
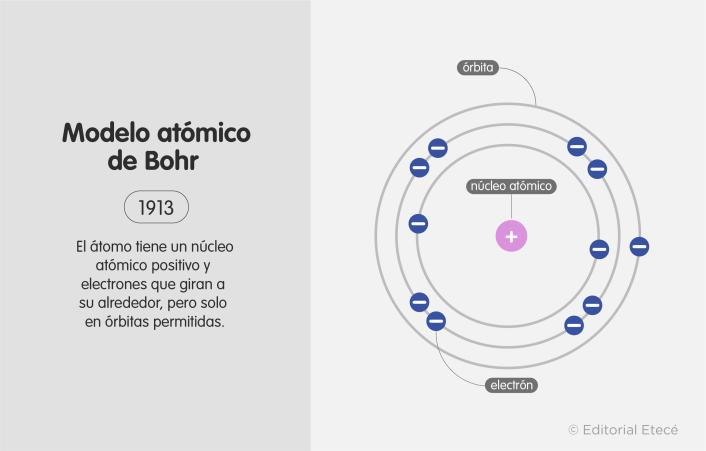
El modelo atómico de Bohr es uno de los modelos atómicos que intentan explicar la estructura del átomo y sus propiedades. Este modelo fue propuesto por el físico danés Niels Bohr en 1913.
Bohr propuso que el átomo de hidrógeno está formado por un núcleo que contiene un protón, y que un electrón que gira alrededor de este núcleo. Este modelo atómico tiene similitud con el movimiento de los planetas alrededor del sol: el núcleo atómico es el sol y los electrones son los planetas girando a su alrededor.
Además, Bohr fue el primero en proponer que los electrones están ubicados en órbitas circulares específicas y permitidas alrededor del núcleo. Esto explicó por qué los átomos no colapsan —según algunos modelos atómicos anteriores, como el de Rutherford, los electrones giran alrededor del núcleo, pero pueden girar en cualquier órbita, lo que provocaría que los electrones colapsen contra el núcleo atómico cuando liberen toda su energía durante el giro—.
En el modelo de Bohr esto no sucede, pues los electrones no pueden ocupar órbitas distintas de las permitidas, es decir, el electrón no puede acercarse al núcleo más allá de la órbita permitida más cercana.
- Ver además: Modelos atómicos
Características del modelo atómico de Bohr
En el modelo atómico de Bohr se intenta explicar la estabilidad de la materia y las líneas que aparecen en los espectros de absorción y emisión de los gases. Para lograr esto, Bohr estableció un conjunto de aproximaciones que describen su modelo:
- Los electrones giran alrededor del núcleo atómico en órbitas circulares específicas, es decir, no pueden girar en cualquier órbita, solo pueden girar en las permitidas.
- Los electrones que rodean el núcleo de un átomo pueden ser internos o externos.
- Los electrones están ubicados en niveles definidos de energía (o sea, en distintas órbitas) y a distancias fijas.
- La órbita más cercana al núcleo tiene la menor energía y la más lejana tiene la mayor energía.
- En cada órbita puede haber un número determinado de electrones, y la forma en que se distribuyen los electrones se denomina configuración electrónica.
- Los electrones pueden saltar de una órbita a otra, pero estos saltos solo pueden ocurrir entre órbitas permitidas.
- Si un electrón salta de una órbita de mayor energía a una de menor energía, este electrón libera energía, que se desprende en forma de fotón o luz. Por otra parte, si salta de una órbita de menor energía a una de mayor energía, este electrón absorbe energía.
Postulados del modelo atómico de Bohr
El modelo atómico de Bohr se basa en tres postulados fundamentales, que se propusieron para intentar explicar los espectros de absorción y emisión de los átomos.
Primer postulado
Los electrones giran describiendo órbitas circulares alrededor del núcleo del átomo, y esto ocurre sin emitir energía.
Para que el electrón describa una órbita circular, su fuerza centrípeta debe ser igual a su fuerza coulombiana.
La fuerza coulombiana es la fuerza proporcional a dos cargas que interactúan, y además, es inversamente proporcional a la distancia entre ellas. En este caso, las partículas que interactúan son el protón y el electrón, cuyas cargas tienen signos contrarios (protón (+) y electrón (-)) se aproximan al valor 1.
La fuerza coulombiana se puede expresar en la siguiente ecuación:
Fc = e2 / r2 (1)
- Donde Fc es la fuerza coulombiana, e es la carga del protón y del electrón, y r es la distancia que separa ambas cargas.
La fuerza centrípeta es la fuerza que experimenta una partícula que describe una trayectoria circular. En este caso, la fuerza centrípeta se puede expresar en la siguiente ecuación:
Fcn = mV2 / r (2)
- Donde Fcn es la fuerza centrípeta, m es la masa del electrón, V es la velocidad del electrón y r es el radio correspondiente a la trayectoria circular que describe.
Luego, la fuerza coulombiana y la fuerza centrípeta se igualan y, de esta manera, el electrón mantiene una trayectoria circular alrededor del núcleo.
Fcn = Fc
mV2 / r = e2 / r2 (3)
Despejando el radio en la ecuación (3), se obtiene una ecuación que permite calcular el radio y la velocidad, y ambos pueden tomar valores infinitos.
r = e2 / 4 πε0 mV2 (4)
- Donde ε0 es la permitividad en el vacío, es decir, la densidad de un campo eléctrico en el vacío cuando está en presencia de cargas eléctricas.
Por otra parte, se puede conocer la energía de una órbita circular que describe el electrón si se conoce el radio de esta órbita. La energía total es la suma de la energía cinética y la energía potencial.
E = Ec + Ep (5)
La energía cinética es la energía que adquiere un cuerpo debido a su movimiento relativo, y se expresa como:
Ec = mV2 / 2 (6)
Pero la ecuación (6) se puede expresar en función del radio de la órbita si se despeja la velocidad al cuadrado de la ecuación (4) y se sustituye en la ecuación (6).
V2 = e2 / 4 πε0mr
Ec = e2 / 8 πε0r (6.1)
La energía potencial es la energía mecánica que se da por la interacción de un cuerpo con un campo de fuerzas, y en este caso se expresa como:
Ep = – e2 / 4 πε0r (7)
Así, sumando la ecuación (6.1) y (7), se obtiene la ecuación que representa la energía de una órbita para el electrón.
E = e2 / 8 πε0r – e2 / 4 πε0r
E = – e2 / 8 πε0r (8)
Segundo postulado
Los electrones del átomo solo pueden encontrarse en órbitas permitidas, que son las que tienen momento angular (L) igual a un múltiplo entero de ℏ.
ħ = ℏ / 2π (9)
- Donde ℏ es la constante de Planck y tiene un valor de 6.626 070 15 × 10-34 J*s.
El momento angular se expresa como:
L / mVr (10)
Así, igualando la ecuación (9) a la ecuación (10), se obtiene la expresión matemática que indica que el momento angular debe ser un múltiplo entero de ℏ. Esta expresión, además, indica que el electrón no puede tener cualquier velocidad, por lo que no puede ocupar cualquier órbita.
mVr = nℏ / 2π (11)
- Donde n se denomina número cuántico principal y toma valores enteros 1, 2, 3, 4…
Despejando la velocidad en la ecuación (11) y sustituyéndola en la ecuación (4) se obtiene la ecuación que representa los radios permitidos (rn). En esta ecuación los radios no pueden tomar valores infinitos como se expresa en el postulado 1, sino que toman valores discretos.
V = nℏ / 2πmr
rn = n2ℏ2ε0 / πe2m (12)
Por otra parte, si se sustituye el radio representado por la ecuación (12) en la ecuación (8), se obtiene la ecuación correspondiente a los valores de energía para cada órbita permitida (En).
En = – e4m / 8ε02n2ℏ2 (13)
Tercer postulado
El electrón solo absorbe o emite energía cuando salta de una órbita permitida a otra, y la energía absorbida o emitida es igual a la diferencia de energía entre las órbitas entre las que salta el electrón. Además, esta energía se absorbe o se emite en forma de fotón.
Cuando el electrón salta de una órbita permitida de mayor energía a una de menor energía, el electrón emite energía en forma de un fotón; mientras que, cuando salta de una órbita permitida de menor energía a una de mayor energía, el electrón absorbe energía en forma de un fotón. La energía de este fotón es igual a:
ΔE = Ef – Ei (14)
- Donde ΔE es la energía absorbida o emitida, y Ef y Ei son las energías de las órbitas permitidas entre las que salta el electrón.
Así, la energía del fotón absorbido o emitido se expresa mediante la ecuación:
Ev = hv = Ei – Ef (15)
- Donde v es la frecuencia.
Entonces, la frecuencia del fotón emitido se puede calcular según:
hv = Ei – Ef = – e4m / 8ε02ni2ℏ2 – [-e4m / 8ε02nf2ℏ2]
hv = Ef – Ei = e4m / 8ε02ℏ2 [1 / nf2 – 1 / ni2]
v = e4m / 8ε02ℏ3 [1 / nf2 – 1 / ni2] (16)
Limitaciones del modelo atómico de Bohr
El modelo de Bohr tuvo éxito en su época, pero tiene algunas limitaciones, especialmente cuando se quiere aplicar a átomos distintos del hidrógeno.
- Bohr propuso que los electrones seguían trayectorias circulares, pero no tenía una base sólida para demostrarlo. Más tarde se demostró que los electrones no necesariamente siguen trayectorias en circulares definidas.
- Este modelo no podía explicar los espectros de emisión de átomos distintos al hidrógeno.
- Este modelo no explicaba la formación de enlaces químicos entre los átomos.
- El modelo de Bohr no es compatible con el Principio de Incertidumbre de Heisenberg, que establece que la velocidad y la posición de un electrón no se pueden conocer simultáneamente.
Sigue con:
Referencias
- Tipler, P.A. (1978). Física vol.2, Editora Guanabara dois, Rio de Janeiro.
- Halliday, D., Resnick, R. y Krane, K. S. (2005) Fundamentos de Física 4: Óptica y Física Moderna. Cuarta edición, Río de Janeiro: Editora LTC.
- Walter J. Lehmann (1972). Atomic and Molecular Structure: the development of our concepts. John Wiley and Sons. ISBN 0-471-52440-9.







¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)