Te explicamos qué es el azufre, y cuáles son sus características y propiedades. Además, entenderás para qué sirve y dónde se encuentra este elemento.

¿Qué es el azufre?
El azufre es un elemento químico de la Tabla Periódica que se representa con el símbolo S. Tiene número atómico 16 y masa atómica 32.065 uma. Es un elemento no metálico que se puede encontrar de color amarillo fuerte, marrón o anaranjado.
El azufre es un elemento químico que se forma en las estrellas masivas, y en la Tierra se encuentra principalmente en las regiones volcánicas. Es muy utilizado en la producción de fertilizantes.
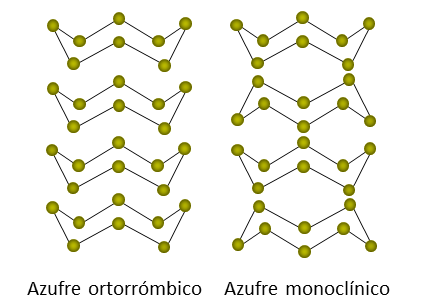
El azufre puede formar distintas sustancias simples cuyas estructuras dependen de cómo están enlazados los átomos de azufre. A estas distintas sustancias simples se les llama alótropos, y se forman cuando se enlazan de forma diferente átomos de un mismo elemento. Los alótropos más conocidos del azufre son el azufre monoclínico y el azufre ortorrómbico, y sus estructuras se representan como:
Ver además: Carbono
Propiedades del azufre
El azufre tiene diferentes propiedades físicas que dependen del alótropo que forma, aunque muchos alótropos del azufre aún no se conocen bien. Por otra parte, el azufre tiene diversas reacciones químicas que dependen del tipo de compuesto químico en que está presente.
Propiedades físicas del azufre
Algunas propiedades físicas del azufre son:
- Es un no metal.
- Suele tener color amarillo, anaranjado o marrón.
- Presenta un olor similar al huevo podrido.
- Sus alótropos más conocidos son el octaedro ortorrómbico y el prisma monoclínico.
- Es insoluble en agua, pero se disuelve en disulfuro de carbono (CS2).
- En todos los estados de agregación forma moléculas de S8.
Propiedades químicas del azufre
Algunas propiedades químicas del azufre son:
- Tiene principalmente estados de oxidación -2, +2, +4 y +6. Pero también forma compuestos químicos en los que actúa con estado de oxidación -1, 0, +1, +3 y +5.
- Reacciona con oxígeno produciendo dióxido de azufre (SO2) y una llama azul.
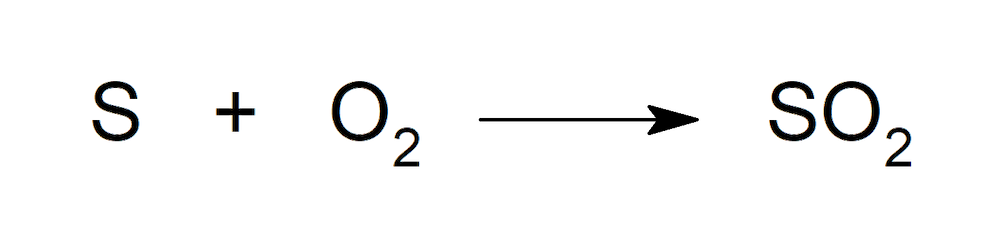
- Cuando forma parte del dióxido de azufre (SO2), reacciona con oxígeno para formar trióxido de azufre.
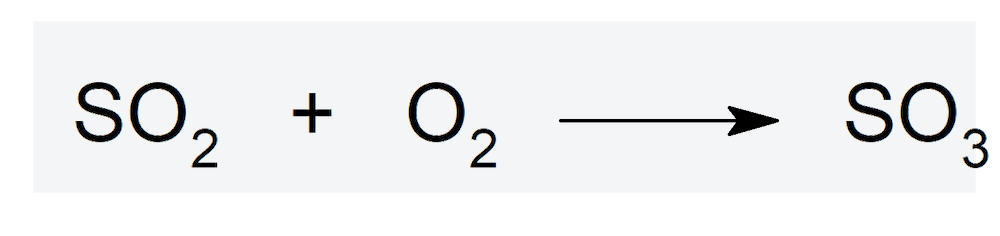
- Cuando forma parte del trióxido de azufre (SO3), reacciona con agua para formar ácido sulfúrico (H2SO4).
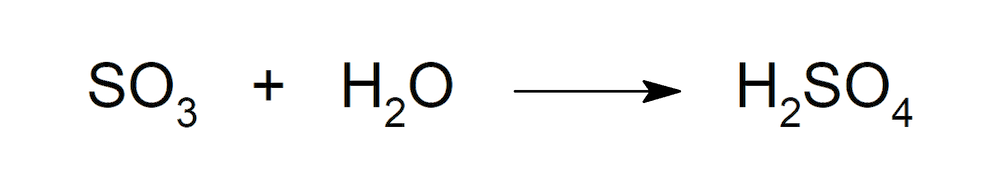
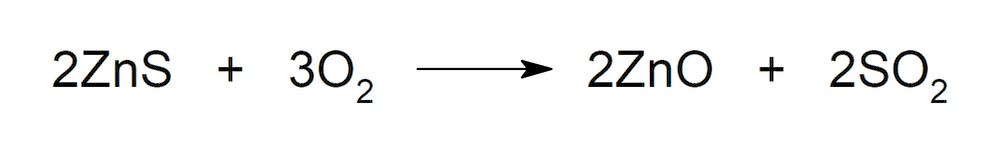
- Cuando forma sulfuros metálicos, por ejemplo, el sulfuro de zinc (ZnS), y es quemado, forma dióxido de azufre (SO2).
¿Para qué sirve el azufre?
El azufre y los compuestos químicos que forma se utilizan en muchos procesos industriales. Se utiliza:
- Para producir ácido sulfúrico, que es un compuesto químico esencial en muchas industrias.
- En la industria fotográfica (se utilizan compuestos de azufre como el tiosulfato de sodio (Na2S2O3) y de amonio ((NH4)2S2O3)).
- En forma de sulfitos para el blanqueamiento del papel y como antioxidantes de alimentos.
- Como laxante y exfoliante cuando forma parte del sulfato de magnesio (MgSO4).
- Para la fabricación de vidrio cuando forma parte del sulfato de cobre (II) (CuSO4).
- En la producción de pesticidas y fertilizantes.
- En la fabricación de pólvora.
- En la producción de fungicidas.
- Como antiséptico.
- Como gas refrigerante.
- En el proceso de refinado del petróleo.
¿Dónde se encuentra el azufre?

El azufre es un elemento bastante abundante en la corteza terrestre. Se encuentra en su forma elemental y en mayor cantidad en zonas volcánicas y cerca de las aguas termales.
También se encuentra formando sulfuros, que son parte de los minerales pirita y galena, y sulfatos, que son parte del mineral aljez. Además, el azufre está presente en los combustibles fósiles como el petróleo y el carbón, y también se encuentra en el gas natural.
Por otro lado, algunas proteínas que forman parte de los organismos vivos contienen azufre, pues es uno de los elementos que forman los aminoácidos metionina y cisteína, que son unidades que forman las proteínas.
Compuestos químicos que contienen azufre

El azufre forma distintos compuestos químicos que difieren en su estructura, aspecto y aplicaciones. Algunos compuestos químicos que contienen azufre son:
- El sulfuro de hidrógeno (H2S). Es un gas incoloro con olor similar al huevo podrido. Además, es muy venenoso.
- El disulfuro de carbono (CS2). Es un líquido muy utilizado como disolvente de azufre y fósforo.
- Los sulfuros metálicos. Son compuestos que pueden encontrarse en muchos minerales como la Acantita, que contiene sulfuro de plata (Ag2S), la calcosina, que contiene sulfuro de cobre (I) (Cu2S), la covellina, que contiene sulfuro de cobre (II) y la galena, que contiene sulfuro de plomo (II) (PbS).
- Los sulfuros de fósforo. Los principales de estos compuestos son el trisulfuro de tetrafósforo (P4S3), el pentasulfuro de tetrafósforo (P4S5), el heptasulfuro de tetrafósforo (P4S7) y el decasulfuro de tetrafósforo (P4S10). Son compuestos amarillos y cristalinos que se pueden utilizar para convertir alcoholes en sus correspondientes compuestos con azufre.
- Los óxidos de azufre. Los principales óxidos de azufre son el monóxido de azufre (SO), el dióxido de azufre (SO2) y el trióxido de azufre (SO3). Puntualmente el SO2 y el SO3 son muy importantes en la industria, sobre todo para producir ácido sulfúrico (H2SO4).
- El ácido sulfúrico (H2SO4). Es un líquido viscoso que reacciona fuertemente con muchos metales. Se utiliza en una infinidad de procesos industriales, a tal punto que la economía de algunos países fue medida con base en la cantidad de ácido sulfúrico que producen.
- Derivados halogenados. Son compuestos formados por azufre y halógenos (cloro (Cl), bromo (Br), flúor (F)). Los principales son el monosulfuro de azufre (S2F2), el disulfuro de azufre (SF2), el tetrafluoruro de azufre (SF4), el monocloruro de azufre (S2Cl2), el dicloruro de azufre (SCl2) y el monobromuro de azufre (S2Br2). En el caso de los monocloruros de azufre se emplean como disolventes de compuestos orgánicos.
Isótopos del azufre
Los isótopos son átomos de un mismo elemento químico que tienen en su núcleo el mismo número de protones, pero distinto número de neutrones. Existen 25 isótopos conocidos del azufre, de todos ellos la mayoría son radiactivos e inestables, por lo que existen por muy poco tiempo.
Los isótopos estables del azufre son:
- Azufre-32 (32S)
- Azufre-33 (33S)
- Azufre-34 (34S)
- Azufre-36 (36S)
Efectos ambientales del azufre
El azufre forma parte del dióxido de azufre (SO2) y el trióxido de azufre (SO3), que son gases emitidos a la atmósfera debido a la quema de productos derivados del petróleo con azufre. Estos productos se queman en centrales que producen electricidad, en vehículos y en distintas industrias.
Cuando el SO2 y el SO3 presentes en la atmósfera reaccionan con el agua atmosférica, se produce ácido sulfuroso (H2SO3) y ácido sulfúrico (H2SO4), que caen con el agua de lluvia hacia la superficie de la Tierra, provocando la llamada lluvia ácida. La lluvia ácida causa daños a los seres vivos en general, a los suelos y a las construcciones hechas por el hombre.
Por otro lado, el ácido sulfhídrico (H2S(ac)) es un compuesto sumamente tóxico que si es liberado al medio ambiente puede provocar la muerte de seres vivos y dañar el entorno que los rodea.
Ciclo del azufre

El ciclo del azufre es el proceso de circulación del azufre en el planeta Tierra. De esta manera, el azufre se transporta entre los seres vivos y el medio ambiente que los rodea. El ciclo del azufre está formado por diferentes etapas:
- Liberación a la atmósfera. Como resultado de la actividad industrial del hombre y de la erupción de los volcanes, se libera azufre en forma de dióxido de azufre (SO2) a la atmósfera.
- Absorción por las plantas. Las plantas incorporan a su organismo el azufre en forma de iones sulfato (SO42-) que contiene el suelo y el agua.
- Consumo por los animales. Los animales herbívoros incorporan el azufre a su organismo cuando comen las plantas que contienen azufre. Luego, los animales carnívoros incorporan el azufre cuando comen a los animales herbívoros.
- Descomposición y liberación al suelo. Algunos microorganismos como bacterias y hongos descomponen las plantas y animales muertos. Durante esta descomposición, estos microorganismos transforman los iones sulfuros (S2-) en sulfatos (SO42-), siendo los sulfatos absorbidos nuevamente por las plantas.
Sigue con:
Referencias
- Sánchez, J., Romieu, I., Ruiz, S., Pino, P., & Gutiérrez, M. (1999). Efectos agudos de las partículas respirables y del dióxido de azufre sobre la salud respiratoria en niños del área industrial de Puchuncaví, Chile. Revista Panamericana de Salud Pública, 6(6), 384-391.
- Goya, P., Román, P., & Elguero, J. (2019). La tabla periódica de los elementos químicos. Los libros de la catarata.
- Holguín Quiñones, S., & Estrada Guerrero, J. M. (2009). El oxígeno, el azufre y las teorías ácido-base. Repositorio institucional. Universidad autónoma metropolitana.



¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)